
����Ŀ�����������Һ��Ӧ���ڵ��º�ϡ����Һ����Ҫ������ClO����Cl������75�����Ϻ�Ũ����Һ����Ҫ������ClO3����Cl�����о�С��������ʵ��װ����ȡ�����(KClO3)�����ⶨ�䴿�ȡ��ش��������⣺
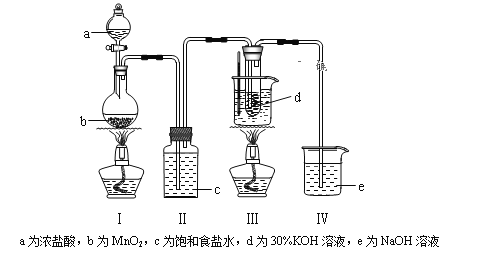
(1)���װ�������Ժ�����ҩƷ����װ�â�ˮ������75�濪ʼ��Ӧ��
��д��װ�â��з�Ӧ�Ļ�ѧ����ʽΪ____________________________��
����ȡ��װ�âԱ�ʵ���Ӱ����____________________________��
��ʵ����������װ�â�ǰΪ�˷�ֹ���������ݳ����ɲ�ȡ�Ĵ�ʩ��_______��
(2)��֪���������£�ClO����ǿ�����ԣ���ClO3�������Ժ��������ʵ��֤�������������£�H2O2�ܱ�ClO�������������ܱ�ClO3��������_________________��
(3)Ϊ�ⶨ��ƷKClO3�Ĵ��ȣ���������ʵ�飺
����1��ȡ2.45g��Ʒ����ˮ���250mL��Һ��
����2��ȡ25.00mL��Һ����ƿ�У�����pH��10���μ�����H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ��
����3���������KI��Һ������μ�������ϡ���ᡣ(ClO3��+6I��+6H+��Cl��+3I2+3H2O)
����4������ָʾ������0.5000 mol��L��1Na2S2O3����Һ�ζ����յ㣬���ı���Һ20.00mL��(2S2O32��+I2��S4O62��+2I��)
�ٲ���2��Ŀ����________��д�����ʱ��Ӧ�Ļ�ѧ����ʽ________��
����Ʒ��KClO3����������Ϊ________��(KClO3��Է���������122.5)
���𰸡�4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O ����HCl����KOH��ʹKClO3���ʽ��� ��װ�â��е���Һ�ӷ�Һ©��ע��Բ����ƿ�� KCl �ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ��A�������ݲ�������ʹ�����ǵ�ľ����ȼ��B���������������ߣ��ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ���ֱ��������ϡ�����ữ���μ�AgNO3��Һ��A�в�����ɫ������B������������ ��ȥClO�� 2H2O2
MnCl2+Cl2��+2H2O ����HCl����KOH��ʹKClO3���ʽ��� ��װ�â��е���Һ�ӷ�Һ©��ע��Բ����ƿ�� KCl �ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ��A�������ݲ�������ʹ�����ǵ�ľ����ȼ��B���������������ߣ��ֱ�ȡ����NaClO��NaClO3��Һ���Թ�A��B�У����μ�����NaOH��Һ���ٷֱ�μ�H2O2��Һ�����Ȼ�������Һ1~2���ӣ���ȴ���ֱ��������ϡ�����ữ���μ�AgNO3��Һ��A�в�����ɫ������B������������ ��ȥClO�� 2H2O2![]() 2H2O + O2�� 83.3%
2H2O + O2�� 83.3%
��������
��װ��I�ж���������Ũ���ᷴӦ�����Ȼ��̡�������ˮ;��װ��I��Ϊ����ʳ��ˮ,���Գ�ȥ�����е��Ȼ���;��������������Һ����װ��I�е�����;�����������Һ��Ӧ,�ڵ��¡�ϡ����Һ����Ҫ������ClO-��Cl- ,��75��C���ϡ�Ũ����Һ����Ҫ������ClO3-��Cl-��(2)�ٲ���2���ڼ�������ClO- ��H2O2��ԭΪCl-,������п���ʹ������H2O2�ֽ�;�ڸ�������,����������, ClO-������H2O2��ClO3-��������H2O2 ;�۸���ClO- +6I- +6H+=Cl- +3I2+3H2O��2S2O32��+I2��S4O62��+2I��,�ɵ÷�Ӧ�Ĺ�ϵʽClO3- ---6S2032-���ù�ϵʽ������Ʒ��KClO3������������
(1) ��װ���ж���������Ũ���ᷴӦ�����Ȼ��̡�������ˮ,��Ӧ���ӷ���ʽ��4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��װ��I��Ϊ����ʳ��ˮ,���Գ�ȥ���е��Ȼ���,��ȡ��װ��II ,����HCl����������������,ʹKClO3���ʽ���;
��ʵ��������װ��ǰΪ�˷�ֹ�������ݳ�,�ɲ�ȡ�Ĵ�ʩ�ǽ�װ��V�е�����������Һ�ӷ�Һ©����ע��Բ����ƿ;�ܚ��������Һ��Ӧ�ڵ��¡�ϡ����Һ����Ҫ������ClO-��Cl- ,��75�����ϡ�Ũ����Һ����Ҫ������ClO-��Cl- ,���Դ�װ��III���Թ��з���õ�KClO3�ֲ�Ʒ�����л��е�������KClO��KCl;
(2) �ٲ���2���ڼ�������ClO-��H2O2��ԭΪC1- ,��Ӧ�����ӷ���ʽ��2H2O2![]() 2H2O + O2��;������п���ʹ������H2O2�ֽ�,����С���Ŀ����ʹ������H2O2�ֽ�,��ֹ������KI;
2H2O + O2��;������п���ʹ������H2O2�ֽ�,����С���Ŀ����ʹ������H2O2�ֽ�,��ֹ������KI;
�ڸ�������,����������, ClO-������H2O2 , CIO-��������H2O2 ,����������ClO3- <C10- ;����25.00mL��Һ�к���KClO3������Ϊxg ;
KCl03---6S2032-
122.5g 6mol
X 0.5mol/L![]() 0.02L
0.02L
X=0.204g ��Ʒ��KCIO3����������Ϊ0.245 ![]() 100%= 83.3%���𰸣�83.3%��
100%= 83.3%���𰸣�83.3%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g) + I2(g)![]() 2HI(g) ��H����a kJ��mol��1
2HI(g) ��H����a kJ��mol��1
��֪�� (a��b��c��������)
(a��b��c��������)
����˵������ȷ����( )
A. ��Ӧ��������������������������
B. �Ͽ�1 mol H��H����1 mol I��I�������������ڶϿ�2 mol H��I����������
C. �Ͽ�2 mol H��I����������ԼΪ(c+b+a) kJ
D. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾװ�ü��������������(FeC2O4��2H2O������ɫ)���ȷֽ�IJ��ֲ������˵����ȷ����( )
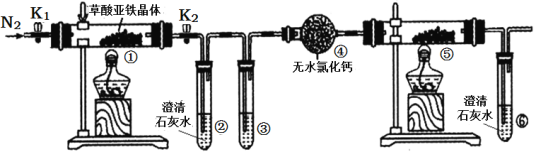
A. ͨ��N2����ҪĿ���Ƿ�ֹ�����е�ˮ�����Բ���������Ӱ��
B. ���ۺ͢��зֱ�ʢ������NaOH��Һ��CuO���壬�ɼ������ɵ�CO
C. ʵ��������е���ɫ��ĩ��ȫ��ɺ�ɫ�������һ��Ϊ��
D. �������е���ˮCaC12������ˮ����ͭ�ɼ���ֽ����ɵ�ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����ƿ������˵������ȷ��һ����
�ٱ���ʹ���¶ȡ��ݻ���һ���̶��ߣ�
�ڲ���������Һ��
�۲����������ȣ���������Ӧ����
��ʹ��֮ǰҪ����Ƿ�©ˮ��
������ƿ������ˮϴ����Ӧ�������������Һ��
A. ���٢ڢۢ� B. ���ڢ� C. ���٢ڢܢ� D. ���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ˮú���ķ�ӦΪ��C��s��+H2O��g��![]() CO��g��+H2��g�� ��H=+131.4kJ��mol-1�����ж���ȷ����
CO��g��+H2��g�� ��H=+131.4kJ��mol-1�����ж���ȷ����
A. ��Ӧ�������ܺʹ��������������ܺ�
B. CO��g��+H2��g��![]() C��s��+H2O��g����H=+131.4kJ��mol-1
C��s��+H2O��g����H=+131.4kJ��mol-1
C. ˮú����Ӧ�У�����1 mol H2��g������131.4 kJ����
D. ˮú����Ӧ������1���CO��g������131.4 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����(����)

A. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
B. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з�����������
C. ʵ��ʱ�����Թ�a��Ŀ���Ǽӿ췴Ӧ���ʲ���ʱ��������������
D. �Թ�b�б���Na2CO3��Һ��������������������������������������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ������������������W�������ӵĺ����������X��Y��Zԭ�ӵĺ����ڲ��������ͬ��X��һ�ֺ����ڿ���ʱ����������һЩ������������ҵ�ϲ���Һ̬��������������Y�ĵ��ʣ���Z�����γ�˫ԭ�ӷ��ӡ�������������������˵����һ����ȷ����( )
A. Ԫ�طǽ����ԱȽ�Ϊ��![]()
B. W��X��Y��Zԭ�ӵĺ����������������ܺ�Ϊ20
C. W��Y���γɼȺ����Թ��ۼ��ֺ��Ǽ��Թ��ۼ��Ļ�����
D. ��W��X��ɵĻ�����ķе��ܵ�����W��Y��ɵĻ�����ķе�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʾ����ȼ���ȵ���( )
A. H2(g) + 1/2O2(g)��H2O(g) ��H��-241.8 kJ/mol
B. 2H2(g) + O2(g)��2H2O(g) ��H��-483.6 kJ/mol
C. H2(g) + 1/2O2(g)��H2O(l) ��H��-285.8 kJ/mol
D. 2H2(g) + O2(g)��2H2O(l) ��H��-571.6 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2A��g��+3B��g��![]() 2C��g��+2D��g�������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ���ʷֱ����£����з�Ӧ����������
2C��g��+2D��g�������ֲ�ͬ������ò�ͬ���ʱ�ʾ�ķ�Ӧ���ʷֱ����£����з�Ӧ����������
A. v (A)=0.15mol/(L��s) B. v (B)=0.5mol/(L��min)
C. v (C)=0.3mol/(L��min) D. v (D)=0.4mol/(L��min)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com