
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA
C. 32 gCu与S完全反应转移的电子数为0.5NA
D. 1mol O2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为2NA
【答案】C
【解析】
根据氧化还原反应的本质和特征分析;根据阿伏伽德罗常数、气体摩尔体积与物质的量之间的关系分析。
A. 5.6gFe物质的量为0.1mol,在氧气中燃烧,生成Fe3O4,完全反应时转移电子数为
![]() NA,故A错误;
NA,故A错误;
B. 标准状况下,22.4 L氦气与22.4 L氯气均为1mol,1molHe含有NA个原子,1molCl2含有2NA个原子,故B错误;
C. 32 gCu是0.5mol,由于S的氧化性弱,只能将Cu氧化成+1价,所以Cu——![]() Cu2S——e-,转移0.5mole-,即转移的电子数为0.5NA,故C正确;
Cu2S——e-,转移0.5mole-,即转移的电子数为0.5NA,故C正确;
D.由于不确定生成Na2O和Na2O2的物质的量,所以无法确定转移电子数,故D错误。
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
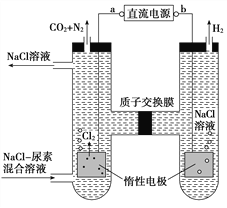
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关周期表的说法正确的是( )
A.短周期是第一、二、三、四周期B.元素周期表有18个族
C.第IA族的元素全部是金属元素D.元素周期表含元素最多的族是副族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸反了烯二酸)和马来酸(顺丁烯二酸)是合成有机物的重要中间体,合成其两种衍生物路线如下:
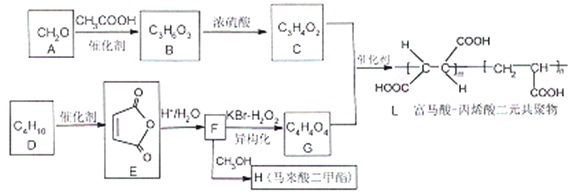
已知: ![]() (R为H或烃基)
(R为H或烃基)
(1)A可发生银镜反应,A的化学名称是_________。
(2)由A生成B、D生成E的反应类型分别是_________、_________。
(3)B中的官能团名称是_________,C的结构简式为_________ 。
(4)写出F生成H的化学方程式_________ 。
(5)P是H的同分异构体,1molP能与碳酸钠反应最多能生成1molCO2,其核磁共振氢谱显示有2种不同化学环境的的氢。峰面积为3:1,写出一种符合要求的P的结构简式_________。
(6)写出用丙酸、甲醇和A为原料制备化合物的![]() 合成路线________。(其他无机试剂任选)
合成路线________。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的说法中正确是
A. 在任何条件下,纯水都呈中性
B. 在任何条件下,纯水的pH=7
C. 在95℃时,纯水中 c(H+)<l0﹣7mol/L
D. 向纯水中加入少量 NaOH固体,水的电离逆向移动,c(OH﹣)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)基态氮原子核外电子占据的原子轨道数目为_________________。
(2)图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是___(填标号)。

(3)NH3的沸点比PH3高,原因是___________________________。
(4)根据等电子原理,NO+电子式为______________。
(5)Na3AsO4中AsO43-的空间构型为______________,As4O6的分子结构如图2所示,则在该化合物中As的杂化方式是______________。
(6)锗的某种氧化物晶胞结构如图3所示,该物质的化学式为____________。已知该晶体密度为7.4g/cm3,晶胞边长为4.31×10-10m。则锗的相对原子质量为____________(保留小数点后一位)。(已知:O的相对原子质量为16,4.313=80,NA=6.02×1023mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
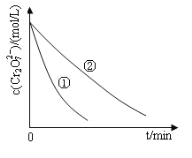
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com