
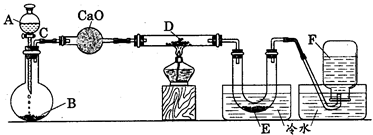
 |
科目:高中化学 来源:不详 题型:填空题
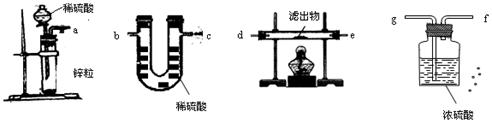
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.容器内气体压强保持不变 |
| B.容器内各物质的浓度不随时间变化 |
| C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时 |
| D.1个N≡N键断裂的同时,有3个H-H键形成 |
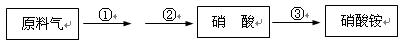
 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
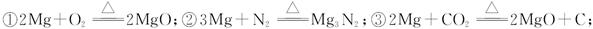

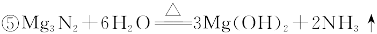
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
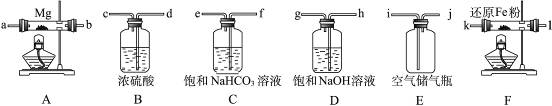
| | 优点 | 缺点 |
| ①甲装置 | | |
| ②乙装置 | | |
| ③丙装置 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
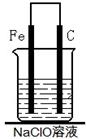
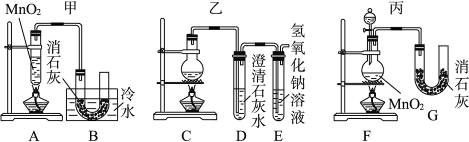
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
|
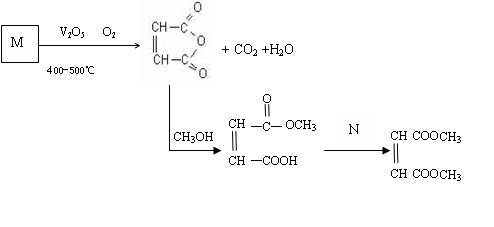 (1)已知烃M的相对分子质量为78,分子内含碳量为92.3%,所有C—H键和碳碳键类型相同,化合物M的化学式为
(1)已知烃M的相对分子质量为78,分子内含碳量为92.3%,所有C—H键和碳碳键类型相同,化合物M的化学式为 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com