
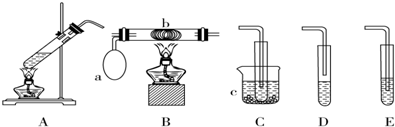
分析 (1)若用A装置做乙醇与乙酸的酯化反应实验,酯化反应还需要有一个除杂收集装置,因此需要连接D装置吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,防止倒吸;A装置液体加热沸腾需要加入碎瓷片/沸石防止暴沸;
(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,冷却得到液体乙醛,应该选用A(提供乙醇)、B(催化氧化装置)、C(收集生成的乙醛),乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象.
解答 解:(1)若用A装置做乙醇与乙酸的酯化反应实验,A中发生反应为:CH3COOH+CH3CH2OH  CH3COOC2H5+H2O,需要连接D装置,不能用连接E,防止倒吸,加入饱和碳酸钠溶液,吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,A装置液体加热沸腾需要加入碎瓷片/沸石,引入汽化中心,防止暴沸,
CH3COOC2H5+H2O,需要连接D装置,不能用连接E,防止倒吸,加入饱和碳酸钠溶液,吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,A装置液体加热沸腾需要加入碎瓷片/沸石,引入汽化中心,防止暴沸,
故答案为:D;饱和碳酸钠溶液;碎瓷片或沸石;
(2)做乙醇氧化成乙醛的实验,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,需要提供乙醇蒸气选择装置A,乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛选择装置B,冷却得到液体乙醛选择装置C,所以装置连接为A、B、C,乙醛溶液进行银镜反应,先制取银氨溶液,正确操作应该是向AgNO3溶液中加入氨水(④)直至最初产生的沉淀恰好溶解为止(②),然后滴入乙醛溶液(①)在水浴中加热反应(③)观察银镜现象,所以实验顺序是④②①③,
故答案为:ABC;④②①③.
点评 本题考查了实验制备和物质性质验证的方法,为高频考点,侧重于学生的分析能力和实验能力的考查,掌握乙醇与乙酸的酯化反应、乙醇催化氧化原理和产物性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质:硫磺、石英、水银 | B. | 化合物:盐酸、食盐、烧碱 | ||
| C. | 混合物:空气、胶体、海水 | D. | 非电解质:铜、蔗糖、酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其单质在常温下与水反应不如钙剧烈 | |
| B. | 其碳酸盐难溶于水 | |
| C. | 其主要化合价为+1价 | |
| D. | 其氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与W形成的化合物均与BaCl2溶液反应产生沉淀 | |
| B. | Z、W的简单离子均可促进水的电离 | |
| C. | 原子半径:X<Y<Z<W | |
| D. | X与Y形成的化合物中均只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 158 | C. | 258 | D. | 101 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com