
【题目】据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号应位于周期表中的( )
A.第六周期ⅣA族B.第七周期ⅥA族
C.第七周期Ⅷ族D.第八周期ⅥA族
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有氯化钠杂质,用下图装置测定试样中纯碱的纯度。主要实验步骤如下:
①按图组装仪器并检查装置的气密性
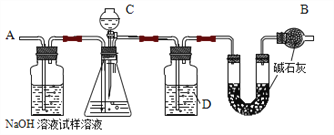
②将 a g 样品放入锥形瓶,加适量水溶解。
③称量装有碱石灰的 U 形管的质量为 b g
④从C 滴下溶液到锥形瓶中无气泡产生
⑤从A 处缓缓鼓入一定量空气后,最终称得U 形管的质量为 c g
(1)B 仪器的名称是_____,其作用为_____。
(2)C 中装的溶液是_____(填字母,下同)D 中装的溶液是_____。
a.稀硫酸 b.浓硫酸 c.氢氧化钠溶液 d.浓盐酸
(3)步骤⑤的目的是_____。
(4)写出纯碱的纯度的计算式_____(用字母表示)。
(5)若实验中发现装置 C 的活塞没塞紧,存在漏气情况,则所测得的结果会_____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素衍生物H是一种具有抗菌作用的化合物,实验室由芳香化合物A制备H的一种合成路线如下:
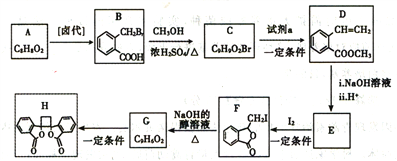
已知:i.RCH2Br![]() R-CH=CH-R
R-CH=CH-R
ii.2R-CH=CH-R'![]()
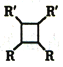 (以上R、R'代表氢或烃基等)
(以上R、R'代表氢或烃基等)
(1)A的化学名称是_____________。C中所含官能团的名称为_______________。
(2)试剂a是____________________,G生成H的反应类型是_____________________。
(3)由F生成G的化学方程式是_______________________________。
(4)D的同分异构体中,能同时满足下列条件的共有_______种(不含立体结构);
①苯环上只有两个取代基
②能使溴的四氯化碳溶液褪色
③既能发生银镜反应又能发生水解反应且水解产物之一能与氯化铁溶液发生显色反应,其中核磁共振氢谱为五组峰的有机物的结构简式为_________________________。
(5)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成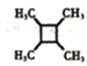 ,写出合成路线_________________(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线_________________(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
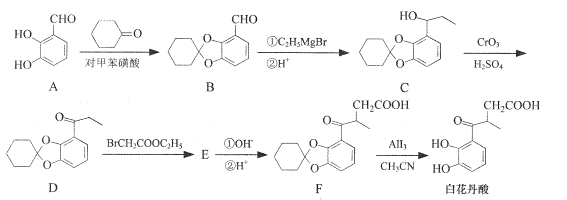
(1)A中的含氧官能团名称为__和_____。
(2)C-D的反应类型为 ___。
(3)白花丹酸分子中混有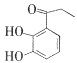 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:____。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:____。
①分子中有四种不同化学环境的氢;②与FeCl3溶液能发生显色反应,且1 mol该物质最多能与3 mol NaOH反应.
(4)E的结构简式为 ___。
(5)已知:![]() 根据已有知识并结合相关信息写出以
根据已有知识并结合相关信息写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(合成路线流程图示例见本题题干)____。
的合成路线流程图(合成路线流程图示例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A、B为原料合成扁桃酸衍生物F路线如下:
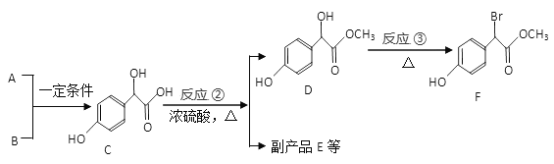
(1) A 的分子式为C2H2O3,1molA 能消耗含有2.5 molCu(OH)2 新制悬浊液,写出反应①的化学方程式_______________________________。
(2)化合物C 所含官能团名称为______________,在一定条件下C 与足量NaOH 溶液反应,1molC 最多消耗NaOH 的物质的量为_________________mol。
(3)反应②的反应类型为___________; 请写出反应③的化学方程式_____________________________。
(4)E 是由2 个分子C生成的含有3 个六元环的化合物,E 的分子式为____________________。
(5)符合条件的F 的所有同分异构体(不考虑立体异构) 有__________种,其中核磁共振氢谱有五组峰的结构简式为____________________。
①属于一元酸类化合物; ②苯环上只有2 个取代基 ③遇FeCl3 溶液显紫色
(6)参照上述合成路线。以冰醋酸为原料(无机试剂任选)设计制备A 的合成路线。己知RCH2COOH ![]() RCH(Cl)COOH______________________
RCH(Cl)COOH______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去Fe(OH)3胶体中混有的FeCl3的方法是_________________。
(2)在一定条件下,某固态化合物X受热分解的反应为:2X ![]() A↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则化合物X的摩尔质量为_______。
A↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则化合物X的摩尔质量为_______。
(3)将标准状况下的a L HCl气体溶于1 L水中,得到的盐酸密度为b g/cm3,则该盐酸的物质的量浓度为________________。
(4)现有某温度下饱和NaCl溶液V mL,密度为ρgcm-3,物质的量浓度为C molL-1则该温度下NaCl的溶解度为_________________(用V、ρ、C表示)。
(5)有A、B、C、D 四种可溶性盐,它们的阳离子是Ba2+、Ag+、Na+、Cu2+ 中的某一种,阴离子是NO3-、SO42-、Cl-、CO32- 的某一种。
①若把四种盐分别溶解于盛有蒸馏水的四只试管中,C盐的溶液呈蓝色。
②若向①的四只试管中分别加盐酸,B溶液有沉淀产生,D溶液有无色无味气体逸出。
根据①②实验事实可推断它们的化学式为:
A、____________ C、______________ D、______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com