
据新浪网报道,欧洲一集团公司拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
A.①② B.③④ C.②③ D.①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铅蓄电池是化学电,它工作时的电池反应为:
PbO2+Pb+2H2SO4===2PbSO4+2H2O。
试回答:
(1)铅蓄电池正极的电极材料是__________。
(2)工作时该铅蓄电池负极的电极反应是________________________。
(3)铅蓄电池工作时,电解质溶液的浓度__________(填“减小”“增大”或“不变”,下同),pH__________。
(4)如果用铅蓄电池做电电解饱和食盐水制取Cl2,当制得0.25 mol Cl2时,在理论上电池内部消耗的H2SO4的物质的量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列叙述中,不正确的是
A、含有共价键的化合物一定是共价化合物
B、共价化合物中一定含有共价键
C、含有离子键的化合物一定是离子化合物
D、双原子单质分子中的共价键一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B、C、D、E五种有机物的有关信息:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为
|
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
A~E中,属于烃的是 (填字母)。
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
C催化氧化生成D的化学方程式为 。
有机物B具有的性质是 (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 H2(g) + I2(g)  2HI(g)的平衡常数K1 ,反应 HI(g)
2HI(g)的平衡常数K1 ,反应 HI(g) 
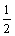 H2(g)+
H2(g)+ 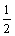 I2(g)的
I2(g)的
平衡常数K2 ,则K1、K2的关系为(平衡常数为同温度下的测定值)
A.K1=2K2 B.K1=K22 C.K1=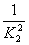 D.K1=
D.K1=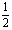 K2
K2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)  pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)= n /m [v(A)]
A.①② B.②③④ C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮是一种有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是( )
A. 蒸发 B. 分液 C.过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A、高温下FeSO4发生如下反应:2FeSO4高温Fe2O3+SO2↑+SO3↑,将生成的气体通入氯化钡溶液中,得到的沉淀物是BaSO3和BaSO4
B、浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+
Fe(OH)2+2H+
若在此溶液中加入盐酸,则Fe2+浓度增大
C、在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分振荡后 ,剩余金属m2g,则m1大于等于m2
D、实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的Na2CO3质量分别为1000mL , 212.0g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com