
【题目】利用下图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):__________________________。
(2)倒入NaOH溶液的正确操作是:______。(从下列选项中选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是__________;反应需要测量温度,每次测量温度后都必须__________;

(4)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 (t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 26.2 | 26.0 | 29.5 | |
2 | 27.0 | 27.4 | 32.3 | |
3 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=______(取小数点后一位).
②上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)____.
a.实验装置保温、隔热效果差
b.用温度计测定H2SO4溶液起始温度后直接测定NaOH溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中. d.仰视量取酸碱溶液
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”或“无影响”)原因是________________________________。
【答案】 )NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol C 减少热量散失 用水将温度计上的液体冲掉,并擦干温度计 ﹣56.8kJ/mol abc 偏小 氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol C 减少热量散失 用水将温度计上的液体冲掉,并擦干温度计 ﹣56.8kJ/mol abc 偏小 氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ
【解析】(1)中和热是在稀溶液中,强酸和强碱发生中和反应生成1molH2O时所放出的热量,由已知中和热数值为57.3kJ/mol,则稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol。
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol。
(2)为减少热量散失,必须一次性迅速倒入NaOH溶液,不能分几次倒入,否则会导致热量散失,影响实验结果,故选C。
(3)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,若两个小孔开得过大,会导致热量散失较多,影响测定结果,所以两个小孔不能开得过大;中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,会使测得结果偏高,所以每次测量后用水将温度计上的液体冲掉,并擦干温度计。
(4)①第1次实验硫酸和NaOH溶液起始平均温度为26.1℃,反应后温度为29.5℃,反应前后温度差为:3.4℃;第2次实验硫酸和NaOH溶液起始平均温度为27.2℃,反应后温度为32.3℃,反应前后温度差为:5.1℃;第3次实验硫酸和NaOH溶液起始平均温度为25.9℃,反应后温度为29.2℃,反应前后温度差为3.3℃;第4次实验硫酸和NaOH溶液起始平均温度为26.3℃,反应后温度为29.8℃,反应前后温度差为3.5℃;因为第2组数据与其他三组数据差别较大,所以第2组数据应舍去;50mL的0.25mol/L硫酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△t得生成0.025mol水放出热量Q=4.18J/(g℃)×100g×![]() ≈1421.2J=1.4212kJ,即生成0.025mol的水放出热量为1.4212kJ,所以生成1mol的水放出热量为:1.4212kJ×
≈1421.2J=1.4212kJ,即生成0.025mol的水放出热量为1.4212kJ,所以生成1mol的水放出热量为:1.4212kJ×![]() ≈56.8kJ,所以该实验测得的中和热△H=-56.8kJ/mol。②实际测量结果比57.3kJ/mol小,由公式Q=cm△t可看出,可能是△t偏小或m偏小造成的,实验装置保温、隔热效果差,会使t2偏小,导致△t偏小;用温度计测定H2SO4溶液起始温度后直接测定NaOH溶液的温度,会使t1偏大,导致△t偏小;分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会使热量散失较多,使t2偏小,导致△t偏小;仰视量取酸碱溶液,会使量取的酸碱溶液偏多,m会偏大。综上分析,abc正确。
≈56.8kJ,所以该实验测得的中和热△H=-56.8kJ/mol。②实际测量结果比57.3kJ/mol小,由公式Q=cm△t可看出,可能是△t偏小或m偏小造成的,实验装置保温、隔热效果差,会使t2偏小,导致△t偏小;用温度计测定H2SO4溶液起始温度后直接测定NaOH溶液的温度,会使t1偏大,导致△t偏小;分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会使热量散失较多,使t2偏小,导致△t偏小;仰视量取酸碱溶液,会使量取的酸碱溶液偏多,m会偏大。综上分析,abc正确。
(5)若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小,因为氨水为弱碱,在水溶液中部分电离,中和反应的同时会有电离过程发生,而电离为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为
A. 25% B. 27.5 % C. 30% D. 37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①硫磺;②FeS2;③CuSO45H2O;④FeSO47H2O;⑤CaSO42H2O,其中可用于制硫酸的是
A. 只有② B. ①和② C. ①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是( )
2CO(g),达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC ②单位时间内生成n molCO2 的同时生成2n mol CO ③CO2 、CO的物质的量浓度之比为1: 2的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
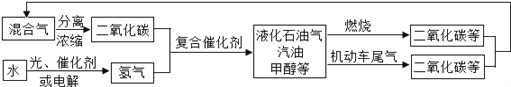
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是不变的;②燃烧时化学能可以转化为热能和光能;
③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;
⑤二氧化碳可成为一种重要的资源。
A. ①②③④ B. ①②③⑤ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家冶炼出了纯度高达99.9999%的铁,根据你的推测,下列性质它不可能具有的是
A.硬度比生铁低 B.在潮湿的空气中放置不易生锈
C.在冷的浓硫酸中可以钝化 D.与4mol/L盐酸反应的速率比生铁快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为![]() ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
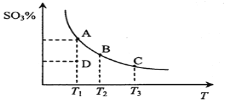
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com