
下列各离子方程式中,属于水解反应且使溶液显碱性的是
A.CH3COOH+OH-= CH3COO-+H2O
B.H2O+H2O H3O++OH-
H3O++OH-
C.NH4+ + H2O NH3·H2O + H+
NH3·H2O + H+
D.PO43-+H2O HPO42-+OH-
HPO42-+OH-
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
A.阴极产物是氢气 B.阳极产物是氧气
C.阴极产物是铝和氧气 D.阳极产物只有氯气
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有机物系统命名正确的是( )
A.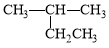 2-乙基丙烷
2-乙基丙烷
B.CH3CH2CH2CH2OH 1-丁醇
C.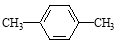 对二甲苯
对二甲苯
D.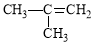 2-甲基-2-丙烯
2-甲基-2-丙烯
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:填空题
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
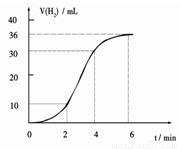
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
编号 | 电极材料 | 电解质溶液 | 电子流动方向 |
1 | Mg Al | 稀盐酸 | Mg流向Al |
2 | Mg Al | NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是
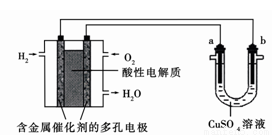
A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是含锌、铁的粗铜,b极是纯铜, a极溶解铜的质量与b极析出铜的质量相等
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量变化和其他各种现象的出现
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ 在①CH2=CH2 ②C6H6 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是________;
(2)属于高分子化合物的是________;
(3)能与Na2CO3溶液反应的是________;
(4)能发生酯化反应的是________;
(5)既能发生取代反应又能发生加成反应的是________。
Ⅱ A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量一定,完全燃烧后所产生的CO2的质量就不变,试写出两组符合上述情况的烃的结构简式:
(1)第一组 和 。
(2)第一组 和 。
(3)A、B应满足的条件是_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:填空题
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
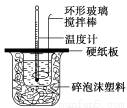
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=______ __。根据计算结果,写出该中和反应的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列能正确表示水解的离子方程式是
A.CH3COOH + H2O 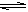 CH3COO- + H3O+
CH3COO- + H3O+
B.NH4+ + H2O 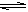 NH3·H2O + H+
NH3·H2O + H+
C.CO32- + 2H2O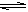 H2CO3 + 2OH-
H2CO3 + 2OH-
D.Br- + H2O 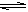 HBr + OH-
HBr + OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com