
【题目】二氧化氮存在下列平衡2NO2 (g) ![]() N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
A.温度130℃,压强3.03×105paB.温度25℃, 压强1.01×105pa
C.温度130℃,压强5.05×104paD.温度0℃, 压强5.05×104pa
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
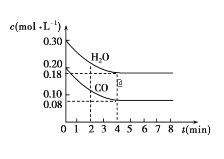
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___mol/(L·min),v(H2)=___mol/(L·min),v(CO2)=___mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
H2 | 0 | 0.062 | c4 | c4 |
①表中3min~4min之间,反应处于___状态;c1___0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___(单选),表中5min~6min之间数值发生变化,可能的原因是___(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列过程的方程式:
(1)小苏打溶于水的电离方程式___。
(2)碳酸钠溶液呈碱性,用离子方程式表示其原因___。
(3)FeCl3 溶液使湿润的淀粉碘化钾试纸变蓝色,写出离子方程式___。
(4)将等物质的量的 NH4HSO4 和 Ba (OH)2 溶液混和的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A.A和 B形成的化合物可作为耐火材料
B.A和C的氢化物的沸点:C>A
C.简单离子半径:E<D<C
D.E和D形成的化合物的电子式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com