
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从菜酿性废液(主要會Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜。
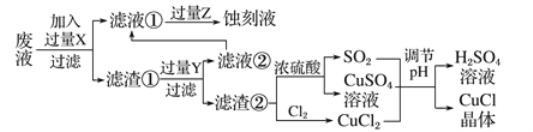
(1)操作①②的名称是_________________。
(2)写出加入过量X发生化合反应的离子方程式:____________________。
(3)生成蚀刻液的离子方程式是式:____________________。
(5)写出生成CuCl的化学方程式式:____________________。298K时, Ksp.(CuCl)=1.2×10-6,要使Cu+沉淀完全,则容液中(Cl-)至少为__________________。洗涤CuCl晶体所用的试剂为____(填序号)。
A.饱和Na2CO3溶液 B.NaOH溶液 C.无水乙醇 D.四氯化碳
(5)准确称取所制得的0.250gCuCl样品置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.100mol/L的Ce(SO4)2溶液滴定到终点,消耗22. 60mLCe(SO4)2溶液。已知有关反应的离子方程式为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+;国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品是否符合国家标准。_____________________
【答案】 过滤 Fe+2Fe3+=3Fe2+ 2Fe2++Cl2=2Fe3++2Cl- CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4 0.12mol/L C 不符合。
【解析】(1)根据图示操作①的名称是过滤。
(2)因要从废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜。先除杂质H+。向工业上以某酸性废液(含![]() 、
、![]() 、
、![]() 、
、![]() 加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜, 加入过量X发生化合反应的离子方程式Fe+2Fe3+=3Fe2+ Cu2++Fe=Cu+ Fe2+ 2H++ Fe= Fe2++H2
加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜, 加入过量X发生化合反应的离子方程式Fe+2Fe3+=3Fe2+ Cu2++Fe=Cu+ Fe2+ 2H++ Fe= Fe2++H2![]()
(3)生成蚀刻液是含有Fe3+的溶液,而溶液中含有大量Fe2+,所以离子方程式是式2Fe2++Cl2=2Fe3++2Cl-
(4)由图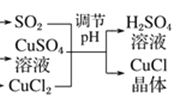 知生成CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4。
知生成CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4。
298K时, Ksp.(CuCl)=1.2×10-6,要使C(Cu+)=1![]() 10-5沉淀完全,C(Cl-)=
10-5沉淀完全,C(Cl-)=![]() 带入数值 C(Cl-)= 0.12mol/L。因为氯化亚铜(CuCl)是一种白色粉末,微溶于水不溶于乙醇及稀硫酸。所以洗涤CuCl晶体所用的试剂为无水乙醇。答案:C。
带入数值 C(Cl-)= 0.12mol/L。因为氯化亚铜(CuCl)是一种白色粉末,微溶于水不溶于乙醇及稀硫酸。所以洗涤CuCl晶体所用的试剂为无水乙醇。答案:C。
(5)根据反应:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+找出关系式
CuCl![]() Fe2+
Fe2+![]() Ce4+
Ce4+
X 0.100mol/L![]() 0.0226L X=2.26
0.0226L X=2.26![]() 10-3 mol
10-3 mol
m(CuCl)= 2.26![]() 10-3 mol
10-3 mol![]() =0.225g
=0.225g
CuCl的质量分数为0.225g/0.250g![]() 100
100![]() =90.00
=90.00![]() <96.50%.所以不符合。
<96.50%.所以不符合。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 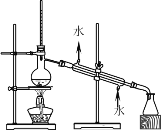 B.
B. 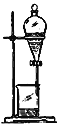
C.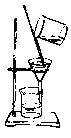 D.
D. 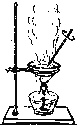
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4L氨气溶于足量水后含有NA个分子
B. lmol/L的NaClO溶液中含有CIO-的数目小于NA
C. 60gSiO2中含有4molSi-O键
D. lmolN2和4molH2充分反应生成NH3时转移电子总数是6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。NO3-的立体构型的名称为_______________,N原子的杂化方式为________________。NO3-的一种等电子体为________________________。
Ⅱ.CuCl是较为常见的十1价铜的化合物。
(3)基态Cu+的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心, Cu原子位于Cl原子构成的四面体体心。每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
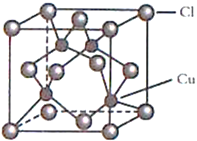 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制480mL 0.2mol·L-1的NaOH溶液:请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为__________
(2)实验步骤主要有计算、称量、溶解、转移和定容。
①完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________。
②溶解和转移过程中玻璃棒的作用分别是__________和__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时仰视刻度线:__________;
③容量瓶洗净后,未经干燥处理:__________;
④将NaOH固体溶解后,直接转至容量瓶中进行实验:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ
B. 平衡后升高温度,混合气体中NO含量降低
C. 平衡后降低压强,混合气体平均摩尔质量增大
D. 平衡时v正(O2)=4/5v逆(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com