
| ���� |
| ���� |
| �¶ȡ�C | 450 | 500 | 550 | 600 |
| SO2��ת����% | 97.5 | 95.8 | 90.50 | 80.0 |
| 1 |
| 2 |
| 0.16mol?L-1 |
| 2min |
| 0.32mol?L-1 |
| 0.4mol?L-1 |
| ���� |
| ���� |
| (0.32)2 |
| (0.08)2��0.84 |
| 400 |
| 21 |
| 400 |
| 21 |


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
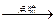 12CO2��g��+4CO(g)+18H2O(l)
12CO2��g��+4CO(g)+18H2O(l)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������������������ֱ���ȫȼ�գ����߷ų��������� |
| B����C��ʯī���TC�����ʯ����H=+1.19kJ?mol-1����֪�����ʯ��ʯī���ȶ� |
| C����H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ?mol-1����֪����0.5molH2SO4��Ũ��Һ�뺬1molNaOH����Һ��ϣ��ų���������57.3kJ |
| D��2gH2��ȫȼ������Һ̬ˮ�ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g���T2H2O��l����H=-285.8kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
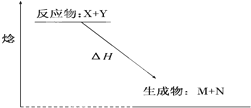
| A����H��0 |
| B��X����һ������M |
| C���÷�ӦΪ���ȷ�Ӧ |
| D���÷�Ӧһ�����ؼ��ȾͿ��Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������²����Է����еķ�Ӧ���ڸ������п����Է����� |
| B�������������ڷ�Ӧ���Է����У��ؼ��ٵķ�Ӧ�����¶������Է����� |
| C�����Է���Ӧ���κ�����¶����ᷢ�� |
| D����H-T��S��Ϊ��ѧ��Ӧ������оݣ����κ������¶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ͬ�������£�2mol������1mol������������С��2molˮ������������ | ||
B��H2��g��+
| ||
C��H2��g��+
| ||
| D���κ������£�2Lˮ�����ֽ��2L������1L����������483.6kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ȼ |
| �� | �� | �� | �� |
| ______ | ______ | ______ | ______ |
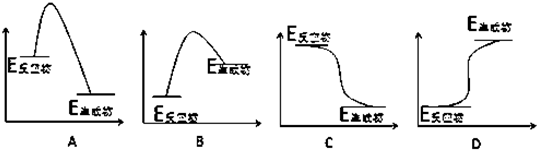
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪c��ʯī��s��=c�����ʯ��s����H��0������ʯ��ʯī�ȶ� |
| B����֪H2��g��+F2��g���T2HF��g����H=-270kJ/mol����2L����������ֽ��1L������1L��������270kJ���� |
| C��HCl��NaOH��Ӧ���к���Ϊ-57.3kJ/mol����H2SO4��Ba��oH��2��Ӧ���к��ȡ�H=2����-57.3��kJ/mol |
| D����֪I2��g��+H2��g���T2HI��g����H1��I2��s��+H2��g���T2HI��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com