
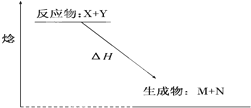
| A.△H>0 |
| B.X能量一定高于M |
| C.该反应为放热反应 |
| D.该反应一定不必加热就可以发生 |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ?mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
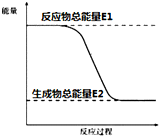
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数 |
| C.沉淀转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动 |
| D.pH为10的氨水,由水电离出的氢氧根离子浓度为10-4mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| 加热 |
| 温度°C | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是放热反应都是自发的 |
| B.铁在潮湿空气中生锈是自发过程 |
| C.自发反应都是熵增大的反应 |
| D.电解池的反应是属于自发反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C+H2O→H2+CO-131.3KJ |
| B.C(s)+H2O(l)→H2(g)+CO(g)+131.3KJ |
| C.C(s)+H2O(g)→H2(g)+CO(g)+131.3KJ |
| D.C(s)+H2O(g)→H2(g)+CO(g)-131.3KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com