
【题目】常温下,不能证明乙酸是弱酸的实验事实是
A.0.1mol·L-1CH3COOH溶液pH>1
B.pH=1CH3COOH溶液稀释100倍,pH<3
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol·L-1CH3COONa溶液的pH大于7
【答案】C
【解析】
A.0.1mol/L的醋酸溶液pH>1,说明溶液中c(H+)<0.1mol/L,说明醋酸的电离不是完全的,那么醋酸即为弱酸,A项可证明;
B.对于强酸而言,由于其电离是完全的,所以在不考虑无限稀释的情况下,体积每增大十倍,根据公式![]() 可知,c(H+)减小十倍,pH增大1;现在对pH=1的醋酸进行稀释,体积扩大到100倍,但pH没有增加到3,说明醋酸不是强酸,B项可证明;
可知,c(H+)减小十倍,pH增大1;现在对pH=1的醋酸进行稀释,体积扩大到100倍,但pH没有增加到3,说明醋酸不是强酸,B项可证明;
C.醋酸可以与碳酸钠溶液反应生成CO2,说明醋酸的酸性强于碳酸,但无法证明醋酸是弱酸,C项不能证明;
D.醋酸钠溶液常温下,pH>7显碱性,是因为发生了醋酸根的水解反应,只有弱酸的酸根才会发生水解反应,所以醋酸是弱酸,D项可证明;
答案选C。


科目:高中化学 来源: 题型:
【题目】向盛有KL溶液的试管中加入少许![]() 后滴加氯水,
后滴加氯水,![]() 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡,![]() 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平![]() 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
 _____
_____
2)整个过程中的还原剂是___。
3)把KL换成KBr,则![]() 层变为__色:继续滴加氯水,
层变为__色:继续滴加氯水,![]() 层的颜色没有变化。
层的颜色没有变化。![]() 、
、![]() 、
、![]() 氧化性由强到弱的顺序是______。
氧化性由强到弱的顺序是______。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含![]() 的食盐)1000kg,若庄Kl与
的食盐)1000kg,若庄Kl与![]() 反应制
反应制![]() ,至少需要消耗
,至少需要消耗![]() ________L(标准状况,保留2位小数)。
________L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有A、B、C、D四种无色溶液,它们分别是溶CH3COONa液、NH4Cl溶液,盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同。
则:(1)①B是___溶液,C是___。
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=___![]() 填某个数
填某个数![]() 。
。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(Ⅰ)上述关系一定不正确的是___![]() 填序号
填序号![]() 。
。
(Ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为___(填序号)。
(Ⅲ)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显___(填“酸性”、“碱性”或“中性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料,经一系列反应可得到HNO3、CO(NH2)2、HCN等产品。
(1)以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式_____。
![]()
(2)以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g) ![]() NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1
反应Ⅱ:NH2COONH4(l) ![]() NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) ![]() NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g) ![]() NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2,测得各组分物质的量随时间变化如图1。下列说法正确的是_____。
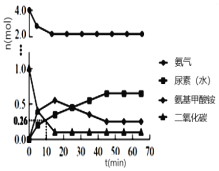
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
(3)工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g) ![]() HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0
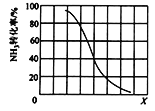
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是_____(填“温度”或“压强”)。

② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=_____(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积固定的密闭容器中发生可逆反应3X(g)![]() 2Y(g)+Z(g),下列能说明达到化学平衡状态的是
2Y(g)+Z(g),下列能说明达到化学平衡状态的是
A.压强不再发生变化B.ΔH的数值不再变化
C.反应物和生成物的浓度不再改变D.Y的生成速率是Z的生成速率的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示:
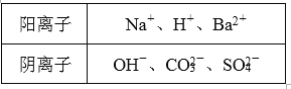
(1)甲的化学式为________________。
(2)乙溶液与丙溶液反应可生成气体M, 则M的化学式为________________,该反应的离子方程式为___________________________________________________。
(3)乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸。
①乙的化学式为________________,如何鉴别乙中的阴离子:___________________________。
②B溶于稀硝酸的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.含0.1molBaCl2的溶液中Cl-数为0.1NA
B.22gCO2所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.标准状况下1mol乙醇分子所占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
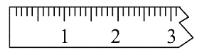
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com