
【题目】已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示:
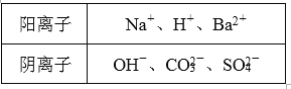
(1)甲的化学式为________________。
(2)乙溶液与丙溶液反应可生成气体M, 则M的化学式为________________,该反应的离子方程式为___________________________________________________。
(3)乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸。
①乙的化学式为________________,如何鉴别乙中的阴离子:___________________________。
②B溶于稀硝酸的离子方程式为___________________________________________________。
【答案】Ba(OH)2 CO2 2H++CO32-===H2O+CO2↑ NaHSO4 取少量样品于试管中,加盐酸无现象,加氯化钡溶液产生白色沉淀,则有硫酸根离子 BaCO3+2H+===Ba2++H2O+CO2↑
【解析】
甲、乙、丙是三种可溶性物质,甲是碱,则甲中含有OH-和Na+或Ba2+,碳酸钡和硫酸钡都是沉淀,所以甲是Ba(OH)2,乙是酸,则乙为H2SO4,丙为Na2CO3;乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸,则A为硫酸钡,B为碳酸钡,据此分析解答。
已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,则甲中含有OH-和Na+或Ba2+,碳酸钡和硫酸钡都是沉淀,所以甲是Ba(OH)2;乙、丙是盐,且都是可溶性盐,乙溶液与丙溶液反应可生成气体M,则应该是硫酸氢钠和碳酸钠,乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸,则A是BaSO4,B应该是BaCO3,则乙是NaHSO4,丙是Na2CO3。
(1)通过以上分析,甲是氢氧化钡,其化学式为Ba(OH)2;
(2)乙是NaHSO4,丙是Na2CO3,乙溶液与丙溶液反应可生成气体M,则M的化学式为CO2,该反应的离子方程式为2H++CO32-=H2O+CO2↑;
(3)①乙的化学式为NaHSO4,鉴别乙中的阴离子的方法:取少量样品于试管中,加盐酸无现象,加氯化钡溶液产生白色沉淀,则有硫酸根离子;
②B应该是BaCO3,B溶于稀硝酸的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)→C(g) Δ H ,分两步进行:① A(g)+B(g)→X(g) Δ H1;② X(g)→C(g) Δ H2;反应过程中能量变化如图所示。下列说法正确的是
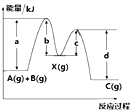
A.d是反应②的活化能
B.Δ H1 = (b - a) kJ ·mol-1
C.Δ H = - (b - c + d - a) kJ·mol-1
D.X是反应A(g) + B(g) → C(g) 的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,不能证明乙酸是弱酸的实验事实是
A.0.1mol·L-1CH3COOH溶液pH>1
B.pH=1CH3COOH溶液稀释100倍,pH<3
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol·L-1CH3COONa溶液的pH大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Ba2+、NO3-、Cl-
C.加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42-
D.c(Fe3+)=1.0mol·L-1的溶液:Na+、CO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)用双线桥法表示电子的转移的方向及数目___。
(2)该反应中的氧化剂是___,还原剂是__。
(3)该反应中的氧化产物是__,还原产物是__。
(4)该反应中体现了稀硝酸的性质有__、__。
(5)将其改为离子反应方程式__。
(6)该反应中氧化剂与还原剂的物质的量之比为__。
(7)若反应中转移的电子的物质的量是0.9mol,则生成NO的体积为__(标准状况),被还原的硝酸为__mol。
(8)H2S+H2SO4(浓)=S↓+SO2↑+2H2O,在该反应中每一摩尔H2SO4参加反应,转移的电子的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是( )
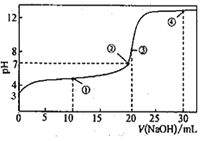
A.弱酸HA的电离平衡常数数量级为10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(H+)+c(HA)>c(OH-)
D.点④所示的溶液中2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com