
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是( )
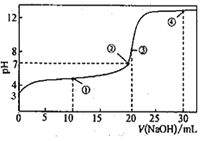
A.弱酸HA的电离平衡常数数量级为10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(H+)+c(HA)>c(OH-)
D.点④所示的溶液中2c(OH-)-2c(H+)=c(A-)+3c(HA)
【答案】C
【解析】
A.根据图像可知未加氢氧化钠前溶液的pH=3,溶液中氢离子浓度是10-3mol/L,HA的浓度是0.1mol/L,所以弱酸HA的电离平衡常数是![]() ,数量级为10-5,A正确;
,数量级为10-5,A正确;
B.点①反应后溶液是NaA与HA物质的量之比为1:1的混合物,根据物料守恒可知2c(Na+)=c(A-)+c(HA),B正确;
C.点③说明两溶液恰好完全反应生成NaA,由于A-水解,根据质子守恒可知c(H+)+c(HA)=c(OH-),C错误;
D.点④反应后溶液是NaA与NaOH物质的量之比为2:1的混合物,由电荷守恒知:c(Na+)+c(H+)=c(A-)+c(OH-),物料守恒可知2c(Na+)=3c(A-)+3c(HA),因此所示的溶液中2c(OH-)-2c(H+)=c(A-)+3c(HA),D正确。
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙是三种可溶性物质。其中甲是碱,乙、丙是盐,它们溶于水后电离产生的所有离子如下表所示:
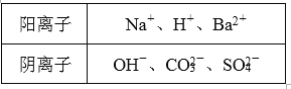
(1)甲的化学式为________________。
(2)乙溶液与丙溶液反应可生成气体M, 则M的化学式为________________,该反应的离子方程式为___________________________________________________。
(3)乙、丙溶液与甲溶液反应可分别生成白色沉淀A和B,其中B可溶于稀硝酸。
①乙的化学式为________________,如何鉴别乙中的阴离子:___________________________。
②B溶于稀硝酸的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
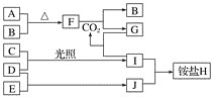
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,发生反应2NO2(g)![]() N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
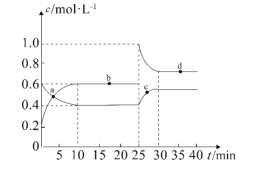
①0~10min的平均反应速率:v((NO2)=___________mol·L-1·min-1。
②a、b、c、d四个点中,表示化学反应速率v(正)>v(逆)的点是___________。
③上述反应反应进行到25min时,继续向容器内充入一定量NO2,重新达到平衡后,混合气体中NO2的体积分数将___________(填“增大”“不变”或“减小”)。该反应的平衡常数K=___________(计算结果保留1位小数)。
(2)一定温度下恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________(填标号)。
a.N2O分解反应中,k(含碘)>k(无碘)b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大d.I2浓度与N2O分解速率无关
(3)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
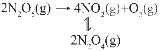
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
①25℃时2NO2(g)![]() N2O4(g)反应的平衡常数Kp=___________kPa-1。
N2O4(g)反应的平衡常数Kp=___________kPa-1。
②t=200min时,测得体系中p(N2O4)=6.5kPa,则此时的N2O5转化率为___________。(计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: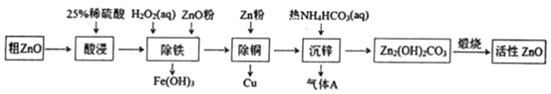
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
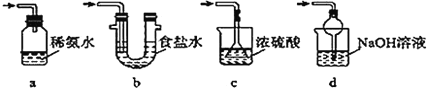
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:实验一:焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
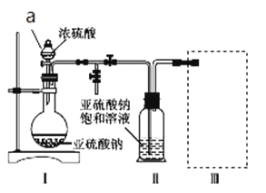
(1)加试剂前要进行的操作是__。装置Ⅰ中产生气体的化学方程式为__。
(2)从装置Ⅱ中分离出产品可采取的分离方法是__。
(3)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为__(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如图:
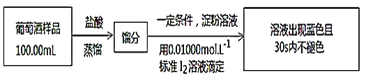
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为__g·L-1。
②若实验过程中有部分HI被空气氧化,则测定结果__(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com