
ΓΨΧβΡΩΓΩΜν–‘―θΜ·–Ω «“Μ÷÷ΕύΙΠΡή–‘ΒΡ–¬–ΆΈόΜζ≤ΡΝœΓΘΡ≥–ΓΉι“‘¥÷―θΜ·–ΩΘ®Κ§ΧζΓΔΆ≠ΒΡ―θΜ·ΈοΘ©ΈΣ‘≠ΝœΡΘΡβΙΛ“Β…ζ≤ζΜν–‘―θΜ·–ΩΘ§≤Ϋ÷η»γΆΦΘΚ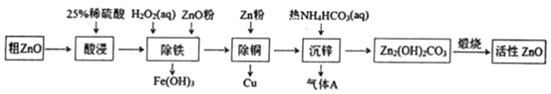
“―÷ΣœύΙΊ«β―θΜ·Έο≥ΝΒμpHΖΕΈß»γ±μΥυ Ψ
ZnΘ®OHΘ©2 | FeΘ®OHΘ©2 | FeΘ®OHΘ©3 | CuΘ®OHΘ©2 | |
ΩΣ Φ≥ΝΒμ | 5.4 | 7.0 | 2.3 | 4.7 |
Άξ»Ϊ≥ΝΒμ | 8.0 | 9.0 | 4.1 | 6.7 |
œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.ΓΑΥαΫΰΓ±÷–25%œΓΝρΥαΩ…”Ο98%≈®ΝρΥα≈δ÷ΤΘ§–η≤ΘΝßΑτΓΔ…’±≠ΓΔΝΩΦρΓΔΫΚΆΖΒΈΙήΒ»“«Τς
B.ΓΑ≥ΐΧζΓ±÷–”ΟZnOΖέΒςΫΎ»ή“ΚpH÷Ν4.1ΓΪ4.7
C.ΓΑ≥ΐΆ≠Γ±÷–Φ”»κZnΖέΙΐΝΩΕ‘÷Τ±ΗΜν–‘―θΜ·–ΩΒΡ≤ζΝΩΟΜ”–”Αœλ
D.ΓΑ≥Ν–ΩΓ±Ζ¥”ΠΈΣ2Zn2++4HCO3©¹®TZn2Θ®OHΘ©2CO3Γΐ+3CO2Γϋ+H2O
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
¥÷―θΜ·–ΩΘ®Κ§ΧζΓΔΆ≠ΒΡ―θΜ·ΈοΘ©Φ”»κœΓΝρΥα»ήΫβΙΐ¬ΥΒΟΒΫ»ή“Κ÷–Κ§”–ΝρΥα―«ΧζΓΔΝρΥαΆ≠ΓΔΝρΥα–ΩΘ§Φ”»κH2O2»ή“Κ―θΜ·―«ΧζάκΉ”ΈΣΧζάκΉ”Θ§Φ”»κ―θΜ·–ΩΒςΫΎ»ή“ΚPH≥ΝΒμΧζάκΉ”ΚΆΆ≠άκΉ”Θ§Φ”»κ–ΩΜΙ‘≠Ά≠άκΉ”ΈΣΆ≠ΒΞ÷ Θ§Ιΐ¬ΥΒΟΒΫΝρΥα–ΩΘ§ΧΦΜ·Φ”»κΧΦΥα«βοß≥ΝΒμ–ΩάκΉ”…ζ≥…Φν ΫΧΦΥα–ΩΘ§Φ”»»Ζ÷Ϋβ…ζ≥…Μν–‘―θΜ·–ΩΘΜ
AΘ°“άΨί»ή“Κ≈δ÷ΤΙΐ≥ΧΖ÷Έω–η“ΣΒΡ“«Τς”–≤ΘΝßΑτΓΔ…’±≠ΓΔΝΩΆ≤ΓΔΫΚΆΖΒΈΙήΒ»ΘΜ
BΘ°“άΨί≥ΝΒμPHΖΕΈßΒςΫΎ»ή“ΚPH ΙΧζάκΉ”ΚΆΆ≠άκΉ”≥ΝΒμΘΜ
CΘ°ΓΑ≥ΐΆ≠Γ±Φ”»κZnΖέΒΡΉς”Ο «Κ§”–Ά≠άκΉ”Θ§ΒςΫΎ»ή“ΚpH≥ΐΨΜΆ≠άκΉ”ΘΜ
DΘ°ΓΑ≥Ν–ΩΓ± ±Φ”»κNH4HCO3»ή“ΚΘ§»ή“Κ÷–ΒΡZn2ΘΪ”κHCO3Θ≠Ζ¥”Π…ζ≥…Zn2Θ®OHΘ©2CO3ΚΆCO2ΓΘ
AΘ°ΥαΫΰΓ±÷–Υυ–η25%œΓΝρΥαΩ…”Ο98%≈®ΝρΥαΘ®ΟήΕ»ΈΣ1.84g/mLΘ©≈δ÷ΤΘ§ «¥÷¬‘≈δ÷Τ‘Ύ…’±≠ΡΎœΓ Ά≈δ÷ΤΘ§Υυ–ηΒΡ“«Τς≥ΐ≤ΘΝßΑτΓΔ…’±≠ΆβΘ§ΜΙ–η“Σ“«Τς”–ΝΩΆ≤ΓΔΫΚΆΖΒΈΙήΒ»Θ§Ι A’ΐ»ΖΘΜ
BΘ°“άΨί≥ΝΒμPHΖΕΈßΒςΫΎ»ή“ΚPH ΙΧζάκΉ”ΚΆΆ≠άκΉ”≥ΝΒμΘ§ΒςΫΎ»ή“ΚPHΈΣ4.1ΓΪ4.7Θ§Ι B’ΐ»ΖΘΜ
CΘ°ΓΑ≥ΐΆ≠Γ±÷–Φ”»κZnΖέ÷ΟΜΜ»ή“Κ÷–ΒΡCuΘ§ΙΐΝΩΒΡZnΖέ“≤Ρή»ήΫβ”ΎœΓΝρΥαΘ§»ή“Κ÷–Zn2+≈®Ε»‘ω¥σΘ§ΒΦ÷¬Μν–‘―θΜ·–ΩΒΡ≤ζΝΩ‘ωΦ”Θ§Ι C¥μΈσΘΜ
DΘ°ΓΑ≥Ν–ΩΓ± ±»ή“Κ÷–ΒΡZn2+”κHCO3©¹Ζ¥”Π…ζ≥…Zn2Θ®OHΘ©2CO3ΚΆCO2Θ§ΖΔ…ζΒΡάκΉ”Ζ¥”ΠΈΣ2Zn2++4HCO3©¹®TZn2Θ®OHΘ©2CO3Γΐ+3CO2Γϋ+H2OΘ§Ι D’ΐ»ΖΘΜ
Ι ―ΓΘΚCΓΘ


 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–Υ»Λ–ΓΉι”ΟΚ§AΓΔBΝΫ÷÷Ϋπ τΒΞ÷ ΒΡΖέΡ©Ή¥ΜλΚœΈοΫχ––»γœ¬ Β―ιΘ§ΤδΉΣΜ·ΙΊœΒ»γœ¬ΆΦΥυ ΨΘ®≤ΩΖ÷Ζ¥”ΠΈοΚΆ…ζ≥…ΈοΈ¥Ν–≥ωΘ©Θ§Τδ÷–EΈΣΑΉ…ΪΫΚΉ¥≥ΝΒμΘ§IΈΣΚλΚ÷…Ϊ≥ΝΒμΓΘΘ®¥ΥΉΣΜ·ΙΊœΒ÷–Υυ”ΟΒΡ ‘ΦΝΕΦ «ΉψΝΩΒΡΘ©

Θ®1Θ©–¥≥ωœ¬Ν–Έο÷ ΒΡΜ·―ß ΫΘΚF____________Θ§G________________ΓΘ
Θ®2Θ©ΫΪΜλΚœΈο÷–ΝΫ÷÷Ϋπ τΖ÷άκΩΣΒΡΉνΦρΒΞΒΡΖΫΖ® «___________ΓΘ
Θ®3Θ©DΓζEΒΡΉΣΜ·÷–Θ§Φ”»κΙΐΝΩΒΡXΩ…Ρή «_____________________ΓΘ
A.±ΞΚΆNaCl»ή“Κ B.NaOH»ή“Κ C.Α±Υ° D.Ba(OH)2»ή“Κ
Θ®4Θ©–¥≥ωœ¬Ν–ΉΣΜ·ΒΡΜ·―ßΖΫ≥Χ ΫΘΚ
AΓζCΘΚ______________________________________________ΘΜ
HΓζIΘΚ_______________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Εΰ‘Σ»θΥαΘ®Φρ–¥ΈΣH2AΘ©»ή“ΚΘ§Α¥œ¬ ΫΖΔ…ζ“ΜΦΕΚΆΕΰΦΕΒγάκΘΚH2A![]() H++HAΘ≠ΓΔHAΘ≠
H++HAΘ≠ΓΔHAΘ≠![]() H++A2Θ≠ΓΘ“―÷ΣœύΆ§≈®Ε» ±ΒΡΒγάκΕ»ΠΝ(H2A)>>ΠΝ(HAΘ≠)Θ§œ÷”–œ¬Ν–ΥΡ÷÷»ή“ΚΘΚ
H++A2Θ≠ΓΘ“―÷ΣœύΆ§≈®Ε» ±ΒΡΒγάκΕ»ΠΝ(H2A)>>ΠΝ(HAΘ≠)Θ§œ÷”–œ¬Ν–ΥΡ÷÷»ή“ΚΘΚ
ΔΌ0.01molΓΛLΘ≠1ΒΡH2A»ή“Κ
ΔΎ0.01molΓΛLΘ≠1ΒΡNaHA»ή“Κ
Δέ0.02molΓΛLΘ≠1ΒΡHCl”κ0.04molΓΛLΘ≠1ΒΡNaHA»ή“ΚΒ»ΧεΜΐΜλΚœ“Κ
Δή0.02molΓΛLΘ≠1ΒΡNaOH”κ0.02molΓΛLΘ≠1ΒΡNaHA»ή“ΚΒ»ΧεΜΐΜλΚœ“Κ
œ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «
A.»ή“ΚΔή“ΜΕ®œ‘Φν–‘B.c(H2A)Ήν¥σΒΡ «Δέ
C.c(A2Θ≠)Ήν–ΓΒΡ «ΔΌD.c(H+)Ήν¥σΒΡ «Δέ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙέ≤λœ¬Ν–AΓΔBΓΔCΓΔDΓΔEΈε÷÷ΝΘΉ”Θ®‘≠Ή”ΜράκΉ”Θ©ΒΡΫαΙΙ Ψ“βΆΦΘ§ΜΊ¥π”–ΙΊΈ ΧβΓΘ
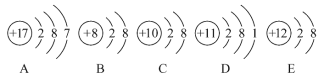
(1)”κάκΉ”œύΕ‘”ΠΒΡ‘ΣΥΊΒΡΖϊΚ≈ «_________Θ§”κ‘≠Ή”œύΕ‘”ΠΒΡάκΉ”ΒΡΫαΙΙ Ψ“βΆΦ «__________
(2)ΒγΉ”≤ψΫαΙΙœύΆ§ΒΡ «Θ®Χν–¥¥ζΚ≈Θ§‘Ύ±Ψ–ΓΧβ÷–œ¬Ά§Θ©_______Θ§–‘÷ ΉνΈ»Ε®ΒΡ «______Θ§Ήν»ί“Ή ß»ΞΒγΉ”ΒΡ «_______Θ§Ήν»ί“ΉΒΟΒΫΒγΉ”ΒΡ «_______ΓΘ
(3)Ω…÷±Ϋ”œύΜΞΫαΚœ–Έ≥…Μ·ΚœΈοΒΡΜ·―ß Ϋ «_______Θ§Ω…Ψ≠ΙΐΒΟ ßΒγΉ”Κσ‘ΌœύΜΞΫαΚœ–Έ≥…Μ·ΚœΈοΒΡΜ·―ß Ϋ «__________ΓΘ
(4)‘ΎΚΥΒγΚ… ΐ1ΓΪ10ΒΡ‘ΣΥΊΡΎΘ§Ν–ΨΌΝΫΗω”κBΒγΉ”≤ψΫαΙΙœύΆ§ΒΡάκΉ”Θ§–¥≥ωάκΉ”ΒΡΖϊΚ≈_______________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§”Ο0.1000molΓΛL-1NaOH»ή“ΚΒΈΕ®20.00mL0.1000molΓΛL-1HA»ή“ΚΥυΒΟΒΈΕ®«ζœΏ»γΆΦΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
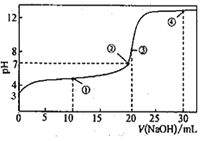
A.»θΥαHAΒΡΒγάκΤΫΚβ≥Θ ΐ ΐΝΩΦΕΈΣ10-5
B.ΒψΔΌΥυ ΨΒΡ»ή“Κ÷–ΘΚ2c(Na+)=c(A-)+c(HA)
C.ΒψΔέΥυ ΨΒΡ»ή“Κ÷–ΘΚc(H+)+c(HA)>c(OH-)
D.ΒψΔήΥυ ΨΒΡ»ή“Κ÷–2c(OH-)-2c(H+)=c(A-)+3c(HA)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β…œ”Ο¥÷―ΈΘ®Κ§Ca2+ΓΔMg2+ΓΔSO42-Β»‘”÷ Θ©ΈΣ÷ς“Σ‘≠Νœ≤…”ΟΓΑΚν œ÷Τ≥«Ζ®Γ±…ζ≤ζ¥ΩΦνΚΆΜ·Ζ NH4ClΘ°ΙΛ“’Νς≥Χ»γΆΦΥυ ΨΓΘœ¬Ν–”–ΙΊΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A. Ε‘¥÷―Έ»ή“Κ≥ΐ‘”Ω…“ά¥ΈΦ”»κNaOHΓΔNa2CO3ΓΔBaCl2Θ§‘ΌΦ”»κ―ΈΥαΒςΫΎ»ή“ΚpH
B. ¥÷―ΈΩ…≤…”Ο≥ΐ‘”ΚΆ÷ΊΫαΨßΒ»Ιΐ≥ΧΧα¥Ω
C. Νς≥ΧΆΦ÷–ΒΡœΒΝ–≤ΌΉς÷–”ΟΒΫΒΡ≤ΘΝß“«ΤςΩ…Ρή”–≤ΘΝßΑτΓΔ…’±≠ΓΔ¬©ΕΖΓΔέαέωΒ»
D. ΗΟΝς≥Χ÷–ΒΟΒΫΒΡΨßΧε”ΟΒΫΝΥ»ήΫβΕ»ΒΡ≤ν“λ–‘
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩS16O2”κ18O2‘ΎΗΏΈ¬ΧθΦΰœ¬ΖΔ…ζΖ¥”Π2SO2+O2![]() 2SO3Θ§¥οΒΫΜ·―ßΤΫΚβΚσΘ§ΤΫΚβΜλΚœΈο÷–Κ§18OΒΡΈΔΝΘ( )
2SO3Θ§¥οΒΫΜ·―ßΤΫΚβΚσΘ§ΤΫΚβΜλΚœΈο÷–Κ§18OΒΡΈΔΝΘ( )
A. ÷Μ”–SO3 B. ÷Μ”–SO2ΓΔSO3 C. ”–SO2ΓΔSO3ΓΔO2 D. ÷Μ”–O2ΓΔSO3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β…œ”Ο¬ΝΆΝΩσΘ®÷ς“Σ≥…Ζ÷ΈΣAl2O3Θ§ΜΙΚ§”–Fe2O3ΓΔFeOΓΔSiO2Θ©÷Τ±Η¬ΝΒΡΡ≥÷÷Μ·ΚœΈοΒΡΙΛ“’Νς≥Χ»γœ¬Θ§œ¬Ν–”–ΙΊΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
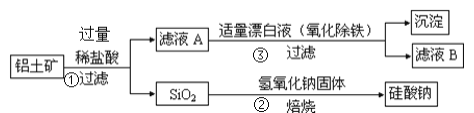
A.œρ¬Υ“ΚA÷–Φ”»κKSCN»ή“Κ,»ή“Κ“ΜΕ®Μα±δΚλ
B.![]() ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ
ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ![]()
C.![]() Τ·ΑΉ“ΚΒΡΡΩΒΡ «―θΜ·≥ΐΧζ,ΗΟΙΐ≥Χ÷–…φΦΑΒΡ―θΜ·ΜΙ‘≠Ζ¥”ΠΈΣ
Τ·ΑΉ“ΚΒΡΡΩΒΡ «―θΜ·≥ΐΧζ,ΗΟΙΐ≥Χ÷–…φΦΑΒΡ―θΜ·ΜΙ‘≠Ζ¥”ΠΈΣ![]()
D.![]() ÷–Τ·ΑΉ“Κ“Σ ΝΩ,»τΙΐΝΩ‘ρΩ…Ρή≤ζ…ζ”–ΕΨΒΡΤχΧ嬻Τχ
÷–Τ·ΑΉ“Κ“Σ ΝΩ,»τΙΐΝΩ‘ρΩ…Ρή≤ζ…ζ”–ΕΨΒΡΤχΧ嬻Τχ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΣΜ·¬Ν( “Έ¬œ¬”κΥ°ΜΚ¬ΐΖ¥”Π) «“Μ÷÷–¬–ΆΈόΜζ≤ΡΝœΘ§ΙψΖΚ”Π”Ο”ΎΦ·≥…Βγ¬Ζ…ζ≤ζΝλ”ρΓΘΜ·―ß―–ΨΩ–ΓΉιΆ§―ßΑ¥œ¬Ν–Νς≥Χ÷Τ»ΓΒΣΜ·¬Ν≤Δ≤βΕ®ΥυΒΟ≤ζΈο÷–AlNΒΡ÷ ΝΩΖ÷ ΐΓΘ
ΦΚ÷ΣΘΚAlNΘΪNaOHΘΪ3H2OΘΫNa[Al(OH)4]ΘΪNH3ΓϋΓΘ
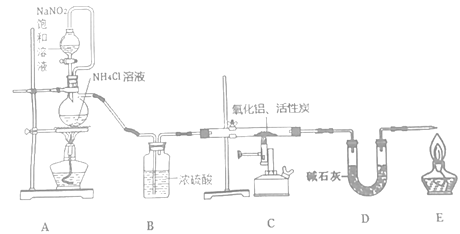
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Φλ≤ιΉΑ÷ΟΤχΟή–‘Θ§Φ”»κ“©ΤΖΘ§ΩΣ Φ Β―ιΓΘΉνœ»Βψ»Φ___(ΓΑAΓ±ΓΔΓΑCΓ±ΜρΓΑEΓ±)¥ΠΒΡΨΤΨΪΒΤΜρΨΤΨΪ≈γΒΤΓΘ
Θ®2Θ©ΉΑ÷ΟA÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___Θ§ΉΑ÷ΟC÷–÷ς“ΣΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___Θ§÷ΤΒΟΒΡAlN÷–Ω…ΡήΚ§”–―θΜ·¬ΝΓΔΜν–‘ΧΩΆβΜΙΩ…ΡήΚ§”–___ΓΘ
Θ®3Θ© Β―ι÷–ΖΔœ÷ΒΣΤχΒΡ≤ζ…ζΥΌ¬ ΙΐΩλΘ§―œ÷Ί”ΑœλΈ≤ΤχΒΡ¥ΠάμΓΘ Β―ι÷–”Π≤…»ΓΒΡ¥κ © «___(–¥≥ω“Μ÷÷¥κ ©Φ¥Ω…)ΓΘ
Θ®4Θ©≥Τ»Γ5.0gΉΑ÷ΟC÷–ΥυΒΟ≤ζΈοΘ§Φ”»κNaOH»ή“ΚΘ§≤βΒΟ…ζ≥…Α±ΤχΒΡΧεΜΐΈΣ1.68 L(±ξΉΦΉ¥Ωω)Θ§‘ρΥυΒΟ≤ζΈο÷–AlNΒΡ÷ ΝΩΖ÷ ΐΈΣ___ΓΘ
Θ®5Θ©“≤Ω…”Ο¬ΝΖέ”κΒΣΤχ‘Ύ1000Γφ ±Ζ¥”Π÷Τ»ΓAlNΓΘ‘Ύ¬ΝΖέ÷–ΧμΦ”…ΌΝΩNH4ClΙΧΧε≤Δ≥δΖ÷ΜλΚœΘ§”–άϊ”ΎAlNΒΡ÷Τ±ΗΘ§Ι≤÷ς“Σ‘≠“ρ «___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com