
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
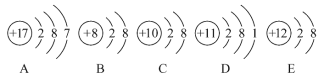
(1)与离子相对应的元素的符号是_________,与原子相对应的离子的结构示意图是__________
(2)电子层结构相同的是(填写代号,在本小题中下同)_______,性质最稳定的是______,最容易失去电子的是_______,最容易得到电子的是_______。
(3)可直接相互结合形成化合物的化学式是_______,可经过得失电子后再相互结合形成化合物的化学式是__________。
(4)在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号_______________
【答案】O、Mg 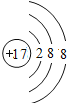 、
、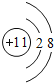 A和D、B和C及E BCE D A BE AD N3-、F-、Na+、Mg2+、Al3+
A和D、B和C及E BCE D A BE AD N3-、F-、Na+、Mg2+、Al3+
【解析】
(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+,则B和E表示的是离子,对应的元素是O、Mg;Ne为稀有气体原子,不形成离子,Cl、Na原子对应的离子结构示意图分别为 、
、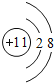 ;
;
(2)电子层结构相同的是A和D、B和C及E,最外层电子达到稳定结构时该微粒性质最稳定,所以性质最稳定的是BCE;最外层电子数越少,越容易失电子,最易失电子的是D;最外层电子数越多(但小于8)越容易得电子,最易电子的是A,故答案为:A和D、B和C及E;BCE;D;A;
(3)阴阳离子可以相互化合得到离子化合物,所以B、E可以相互化合得到化合物;活泼金属原子和活泼非金属原子可以通过得到电子得到离子化合物,A、D可以通过得失电子形成化合物,故答案为:BE;AD;
(4)在核电荷数为1-10的元素内,与B的电子层结构相同的离子有F-、Na+、Mg2+、Al3+等,故答案为:N3-、F-、Na+、Mg2+、Al3+。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知下述四个实验均能发生化学反应:

下列判断不正确的是( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+只显还原性
C.实验③中发生的是置换反应
D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D具有酸性和强氧化性,是一种高效广谱杀菌剂,其制备路线如下:
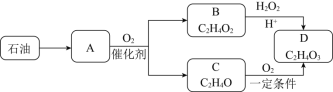
已知:A在标况下的密度为1.25gL-1,B具有酸性,C能发生银镜反应。请回答:
(1)A的结构简式______。
(2)C→D的反应类型______。
(3)B→D的化学方程式______。
(4)下列说法不正确的是______。
A.由石油得到A的方法称为裂化
B.若A在一定条件下能与B发生加成反应,则其产物可能为乙酸乙酯
C.有机物D能杀菌消毒的主要原因是含有-COOH结构
D.C能使高锰酸钾酸性溶液和溴水褪色,其原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在3个体积相同的恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
CO | H2O(g) | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中不正确的是
A.容器②中热量变化:Q1=65.6kJ
B.平衡后容器①②中各组分体积分数相同
C.三个容器达平衡时,①中的CO、②中的H2O(g)、③中的CO2的转化率相等
D.保持相同条件,向平衡后的容器①中再加入0.1molCO和0.4molCO2(g),平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,发生反应2NO2(g)![]() N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
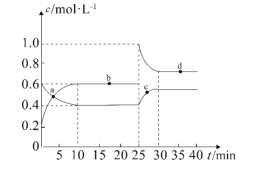
①0~10min的平均反应速率:v((NO2)=___________mol·L-1·min-1。
②a、b、c、d四个点中,表示化学反应速率v(正)>v(逆)的点是___________。
③上述反应反应进行到25min时,继续向容器内充入一定量NO2,重新达到平衡后,混合气体中NO2的体积分数将___________(填“增大”“不变”或“减小”)。该反应的平衡常数K=___________(计算结果保留1位小数)。
(2)一定温度下恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________(填标号)。
a.N2O分解反应中,k(含碘)>k(无碘)b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大d.I2浓度与N2O分解速率无关
(3)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
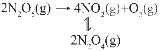
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
①25℃时2NO2(g)![]() N2O4(g)反应的平衡常数Kp=___________kPa-1。
N2O4(g)反应的平衡常数Kp=___________kPa-1。
②t=200min时,测得体系中p(N2O4)=6.5kPa,则此时的N2O5转化率为___________。(计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
D.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: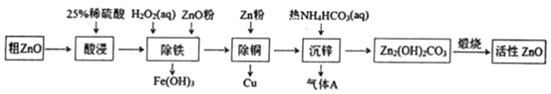
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
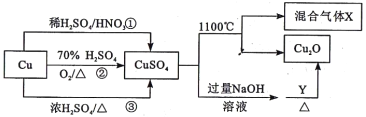
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③
C. 硫酸铜在1100℃分解的方程式为:2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑
Cu2O+SO2↑+SO3↑+O2↑
D. 当Y为葡萄糖时,葡萄糖发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向25mL0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10—4.7)。下列说法正确的是
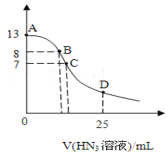
A.水电离出的c(H+):A点大于B点
B.从A点到C点,都存在c(Na+)>c(N3—)>c(OH—)>c(H+)
C.在C点,滴加的V(HN3)>12.5mL
D.在D点,c(Na+)=2c(HN3)+2c(N3—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com