
����Ŀ��ij��Ԫ���ᣨ��дΪH2A����Һ������ʽ����һ���Ͷ������룺H2A![]() H++HA����HA��
H++HA����HA��![]() H++A2������֪��ͬŨ��ʱ�ĵ������(H2A)>>��(HA��)����������������Һ��
H++A2������֪��ͬŨ��ʱ�ĵ������(H2A)>>��(HA��)����������������Һ��
��0.01mol��L��1��H2A��Һ
��0.01mol��L��1��NaHA��Һ
��0.02mol��L��1��HCl��0.04mol��L��1��NaHA��Һ��������Һ
��0.02mol��L��1��NaOH��0.02mol��L��1��NaHA��Һ��������Һ
����˵���в���ȷ����
A.��Һ��һ���Լ���B.c(H2A)�����Ǣ�
C.c(A2��)��С���Ǣ�D.c(H+)�����Ǣ�
���𰸡�D
��������
��Һ������Ҫ��������H2A�������룬����H2A�����ᣬ����������������еij̶ȶ���С����Һ������Ҫ�����ļ���HA-�ĵ��룬����HA-��ˮ�⣬�����������̽��еij̶ȶ���С����Һ�ۣ�������Һ���ʱ����ǿ��������ķ�Ӧ��![]() �����ǵ���Ϻ���������ӣ����Կ�����Ϊ��Һ����Ũ�Ⱦ�Ϊ0.01mol/L��NaHA��H2A�Ļ����Һ����Һ�ܣ�������Һ���ʱ��������кͷ�Ӧ��
�����ǵ���Ϻ���������ӣ����Կ�����Ϊ��Һ����Ũ�Ⱦ�Ϊ0.01mol/L��NaHA��H2A�Ļ����Һ����Һ�ܣ�������Һ���ʱ��������кͷ�Ӧ��![]() �����ǵ���Ϻ���Һ��������ӣ����Կ�����Ϊ��Һ����Ũ��Ϊ0.01mol/L��Na2A��Һ��
�����ǵ���Ϻ���Һ��������ӣ����Կ�����Ϊ��Һ����Ũ��Ϊ0.01mol/L��Na2A��Һ��
A��ͨ��������֪����Һ��һ���Լ��ԣ�A����ȷ��
B��ͨ��������֪��������Һ����ڣ�H2A�����ɽ��г̶Ƚ�С��ˮ����̵����ģ�������c(H2A)����С�����������ų���Һ����ڣ�����Һ���������Һ�٣�����Һ��������Ϸ��������˾���ͬŨ�ȵ�H2A�⣬�����д�����NaHA�� H2A��һ�����뷽��ʽΪ��![]() �������Һ���д������ڵ�HA-��Ȼ������H2A�ĵ��룬���ԣ���Һ����c(H2A)����B����ȷ��
�������Һ���д������ڵ�HA-��Ȼ������H2A�ĵ��룬���ԣ���Һ����c(H2A)����B����ȷ��
C��ͨ��������֪����Һ���е�A2-ֻ����H2A�ĵڶ��������������Һ�ں͢��е�A2-���Ը�ֱ�ӵ�����Һ�д������ڵ�HA-�����������Һ�ܵ����ʼ�ΪNa2A��A2-��������ˮ���������������ģ������Һ���е�A2-Ũ����С��C����ȷ��
D��ͨ����������Һ��ΪNa2A����Һ��һ���Լ��ԣ�c(H+)��С����Һ���������Һ�ڣ�������ϳ��˾��е�Ũ�ȵ�NaHA�⣬���д��������Ը�ǿ��H2A���������Ԣۣ��ڣ���Һ���������Һ�٣�������Ϸ���������H2AŨ����ͬ���������д�����HA-��������H2A�ĵ��룬�������Ԣۣ��٣���ˣ�c(H+)�����Ǣ٣�D�����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��������ݻ���Ϊ2L�ĺ����ܱ������з�����Ӧ��CO(g) + Cl2(g) ![]() COCl2(g)������������5 minʱ����ƽ�⡣
COCl2(g)������������5 minʱ����ƽ�⡣
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 4.0 | 4.0 | 0 | 3.2 |
�� | 500 | 4.0 | a | 0 | 2.0 |
�� | 600 | 2.0 | 2.0 | 2.0 | 2.8 |
����˵������ȷ����
A.a = 2.2 mol
B.��������ǰ5 min��ƽ����Ӧ����v(CO) = 0.08 mol��L-1��min-1
C.�÷�Ӧ��500��ʱ��ƽ�ⳣ��K = 5
D.����������ʼͶ��ΪCO 2.0 mol��Cl2 2.0 mol��ƽ��ʱCOת����С��80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��½�CaCO3�����ܱ���������У���ӦCaCO3(s)![]() CaO(s)+CO2(g)�ﵽƽ�⣬�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵������ȷ����
CaO(s)+CO2(g)�ﵽƽ�⣬�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵������ȷ����
A.ƽ�������ƶ�B.ѹǿ����
C.ƽ�ⳣ������D.��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���D�������Ժ�ǿ�����ԣ���һ�ָ�Ч����ɱ���������Ʊ�·�����£�
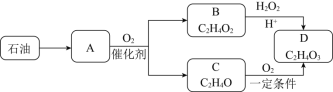
��֪��A�ڱ���µ��ܶ�Ϊ1.25gL-1��B�������ԣ�C�ܷ���������Ӧ����ش�
��1��A�Ľṹ��ʽ______��
��2��C��D�ķ�Ӧ����______��
��3��B��D�Ļ�ѧ����ʽ______��
��4������˵������ȷ����______��
A����ʯ�͵õ�A�ķ�����Ϊ�ѻ�
B����A��һ������������B�����ӳɷ�Ӧ������������Ϊ��������
C���л���D��ɱ����������Ҫԭ���Ǻ���-COOH�ṹ
D��C��ʹ�������������Һ����ˮ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯����(������Һ)��ת����ϵ����֪�ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬C�ʻ���ɫ��������F�ǵ���ɫ���壬������G����ɫ��ӦΪ��ɫ����������Jͨ��״���³���̬��D��E��Ӧ����һ�ִ̼�����ζ�����塣
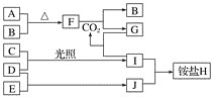
��ش��������⣺
(1)E��J�Ļ�ѧʽ�ֱ���________��________��
(2)д��F��CO2��Ӧ�Ļ�ѧ����ʽ���õ����ŷ���ʾ����ת�Ƶ������_________��
(3)����������Cͨ��ʢ�е��۵⻯����Һ���Թ��У���Һ����ɫ���÷�Ӧ�����ӷ���ʽΪ_________��
(4)�����3.36 L����B��A��ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�T��ʱ����3�������ͬ�ĺ����ܱ������з�����ӦCO(g)��H2O(g)![]() CO2(g)��H2(g)��H=��41kJ��mol��1������ʼʱͶ�ϡ������ʵ��������ƽ�������ϵ�����ı仯�����ʾ��
CO2(g)��H2(g)��H=��41kJ��mol��1������ʼʱͶ�ϡ������ʵ��������ƽ�������ϵ�����ı仯�����ʾ��
������� | ��ʼʱ���������ʵ���/mol | ��ƽ�������ϵ�����ı仯(��Ϊ��ֵ) | |||
CO | H2O(g) | CO2 | H2 | ||
�� | 1 | 4 | 0 | 0 | 32.8kJ |
�� | 8 | 2 | 0 | 0 | Q1 |
�� | 0 | 0 | 1 | 4 | Q2 |
����˵���в���ȷ����
A.�������������仯��Q1��65.6kJ
B.ƽ��������٢��и�������������ͬ
C.����������ƽ��ʱ�����е�CO�����е�H2O(g)�����е�CO2��ת�������
D.������ͬ��������ƽ�������������ټ���0.1molCO��0.4molCO2(g)��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У�������Ӧ2NO2(g)![]() N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
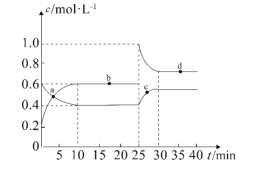
��0��10min��ƽ����Ӧ���ʣ�v((NO2)=___________mol��L��1��min��1��
��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����v(��)��v(��)�ĵ���___________��
��������Ӧ��Ӧ���е�25minʱ�������������ڳ���һ����NO2�����´ﵽƽ����������NO2�����������___________(������������������������С��)���÷�Ӧ��ƽ�ⳣ��K=___________(����������1λС��)��
��2��һ���¶��º��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g)![]() 2I(g)(�췴Ӧ)
2I(g)(�췴Ӧ)
�ڶ���I(g)+N2O(g)��N2(g)+IO(g)(����Ӧ)
������IO(g)+N2O(g)��N2(g)+O2(g)+I(g)(�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5��kΪ���ʳ����������б�����ȷ����___________(����)��
a��N2O�ֽⷴӦ�У�k(����)>k(�⣩b����һ�����ܷ�Ӧ�������������
c���ڶ�����ܱȵ�������d��I2Ũ����N2O�ֽ�������
��3��F.Daniels�������ò�ѹ���ڸ��Է�Ӧ�����о���25��ʱN2O5(g)�ֽⷴӦ��
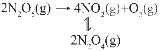
����NO2����ΪN2O4�ķ�Ӧ����Ѹ�ٴﵽƽ�⣬��ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ��t=��ʱ��N2O5(g)��ȫ�ֽ⣩��
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | �� |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
��25��ʱ2NO2(g)![]() N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
��t=200minʱ�������ϵ��p(N2O4)=6.5kPa�����ʱ��N2O5ת����Ϊ___________��(����������1λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��һ�ֶ���Ե����������ϡ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п��������ͼ��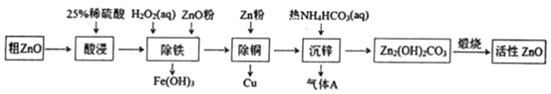
��֪��������������pH��Χ�����ʾ
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ���� | 8.0 | 9.0 | 4.1 | 6.7 |
����˵������ȷ���ǣ� ��
A.���������25%ϡ�������98%Ũ�������ƣ��貣�������ձ�������ͷ�ιܵ�����
B.������������ZnO�۵�����ҺpH��4.1��4.7
C.����ͭ���м���Zn�۹������Ʊ���������п�IJ���û��Ӱ��
D.����п����ӦΪ2Zn2++4HCO3���TZn2��OH��2CO3��+3CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������
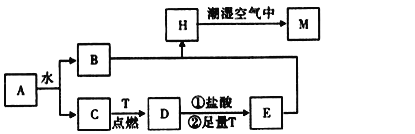
��1������A�Ļ�ѧʽΪ___��
��2��H�ڳ�ʪ�����б��M��ʵ��������__����ѧ����ʽΪ___��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ__���г�A��һ����Ҫ��;__��
��4����Ӧ�ٵ����ӷ���ʽΪ__���ڼ�����T��Ŀ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com