
【题目】一定温度下,在三个容积均为2L的恒容密闭容器中发生反应:CO(g) + Cl2(g) ![]() COCl2(g)其中容器Ⅰ中5 min时到达平衡。
COCl2(g)其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 4.0 | 4.0 | 0 | 3.2 |
Ⅱ | 500 | 4.0 | a | 0 | 2.0 |
Ⅲ | 600 | 2.0 | 2.0 | 2.0 | 2.8 |
下列说法不正确的是
A.a = 2.2 mol
B.容器Ⅲ中前5 min的平均反应速率v(CO) = 0.08 mol·L-1·min-1
C.该反应在500℃时的平衡常数K = 5
D.若容器Ⅰ起始投料为CO 2.0 mol、Cl2 2.0 mol,平衡时CO转化率小于80%
【答案】C
【解析】
A.Ⅰ和Ⅱ的温度相同,则平衡常数相同,利用平衡常数求a的数值。
利用三等式,对于Ⅰ有,体积为2L:

化学平衡常数![]() ;温度不变化学平衡常数不变,则Ⅰ和Ⅱ化学平衡常数相等,对于Ⅱ有,体积为2L:
;温度不变化学平衡常数不变,则Ⅰ和Ⅱ化学平衡常数相等,对于Ⅱ有,体积为2L:

化学平衡常数![]() ,求得a=2.2,正确,A不选;
,求得a=2.2,正确,A不选;
B.容器Ⅱ中反应达到平衡时间小于5min,根据方程式知,实际上生成0.8molCOCl2消耗0.8molCO,容器Ⅲ中前5min的平均反应速率![]() 正确,B不选;
正确,B不选;
C.根据A判断500℃时化学平衡常数为10,错误,C选;
D.若容器Ⅰ起始投料CO2.0mol、Cl22.0mol,与原平衡相比,达到新的平衡时,相当于在原平衡的基础上再减小压强,平衡逆向移动,导致CO转化率减小,Ⅰ中CO转化率=![]() ×100%=80%,则CO转化率小于80%,正确,D不选。
×100%=80%,则CO转化率小于80%,正确,D不选。
答案选C。


科目:高中化学 来源: 题型:
【题目】某科研小组利用石油分馏产品合成一种新型香料的流程图如下。
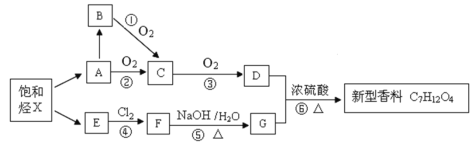
已知X分子中碳氢质量比为24∶5,X有多种裂解方式,其中A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
信息提示:卤代烃在强碱水溶液中发生水解(取代)反应生成醇。如:R-CH2CH2Cl![]() RCH2CH2OH+HCl(水解反应)
RCH2CH2OH+HCl(水解反应)
(1)C中官能团的名称为______________。
(2)请写出X的直链结构简式______________。
(3)下列说法正确的是______________。
A.可用金属钠鉴别B和G
B.E在一定条件下与氯化氢发生加成反应的产物有2种
C.D和G以1:1反应可生成分子式为C5H10O2的有机物
D.E→F的反应类型为取代反应
(4)请写出A→B的反应______________。
(5)B与D在浓硫酸作用下生成甲,写出与甲同类别的同分异构体的结构简式______________(不包括甲)。
(6)写出⑥的化学反应方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.4kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) △H=-48.4kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) △H=-48.4kJ·mol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-5517.6kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=-5517.6kJ·mol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=+5517.6kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=+5517.6kJ·mol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-48.4kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=-48.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。
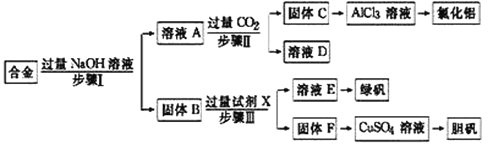
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_______________。实验室中进行该操作时,用到的玻璃仪器有烧杯、______________________。
(2)溶液A中的阴离子主要有__________________;由合金生成A溶液的离子方程式为:_______________。试剂X是________________。
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为_________________。
(4)从环境保护角度考虑,采用固体F加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,其化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)→C(g) Δ H ,分两步进行:① A(g)+B(g)→X(g) Δ H1;② X(g)→C(g) Δ H2;反应过程中能量变化如图所示。下列说法正确的是
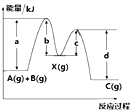
A.d是反应②的活化能
B.Δ H1 = (b - a) kJ ·mol-1
C.Δ H = - (b - c + d - a) kJ·mol-1
D.X是反应A(g) + B(g) → C(g) 的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1000 mol·L-1 NaOH溶液中逐滴加入0.1000 mol·L-1 的某一元酸HX,溶液pH变化曲线如图。下列说法不正确的是
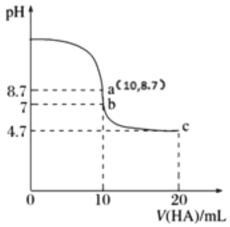
A.等浓度的 HX、NaX 混合溶液中,HX的电离程度大于X- 的水解程度
B.c点所示溶液中存在:2c(H+) - 2c(OH-) = c(X-) - c(HX)
C.a、b、c点所示溶液中,由水电离出的 c(H+)·c(OH-) 值不变
D.a →c点所示溶液中,c(X-) + c(HX) + c(Na+) = 0.1000 mol·L-1 始终成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-。已知相同浓度时的电离度α(H2A)>>α(HA-),现有下列四种溶液:
H++A2-。已知相同浓度时的电离度α(H2A)>>α(HA-),现有下列四种溶液:
①0.01mol·L-1的H2A溶液
②0.01mol·L-1的NaHA溶液
③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液
④0.02mol·L-1的NaOH与0.02mol·L-1的NaHA溶液等体积混合液
下列说法中不正确的是
A.溶液④一定显碱性B.c(H2A)最大的是③
C.c(A2-)最小的是①D.c(H+)最大的是③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com