
| A、金属具有良好的延展性,是因为晶体中的原子层可以相对滑动而不破坏金属键 |
| B、可用“电子气理论”解释金属具有良好的导电性 |
| C、常温下,金属单质都以金属晶体的形式存在 |
| D、温度越高,金属的导电性越弱 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+.、OH-、Cl- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、Mg2+、CO32-、SO42- |
| D、H+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向铬酸钾饱和溶液中加硫酸,溶液由黄色变为橙色 |
| B、对于可逆反应N2(g)+3H2(g)?2NH3(g)增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C、将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蓝色的CoCl2盐酸溶液中加少量水,溶液变紫色 |
| B、工业合成氨常采用较高压强(20MPa~30 MPa)下进行,以提高原料利用率 |
| C、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
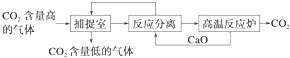
| A、①③ | B、②④ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、H+、C1-、OH- |
| B、Na+、Ba2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com