
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |


科目:高中化学 来源: 题型:
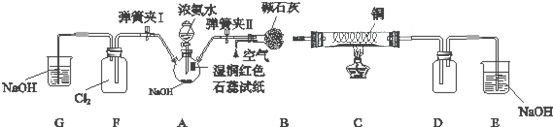
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、①③④⑥ |
| C、③④⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
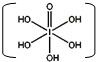 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6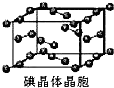 A、用均摊法可知平均每个晶胞中有4个碘原子
A、用均摊法可知平均每个晶胞中有4个碘原子查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲保持压强不变,乙保持体积不变 |
| B、甲保持体积不变,乙保持压强不变 |
| C、混合气体密度甲小于乙 |
| D、混合气体的平均相对分子质量甲小于乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com