
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
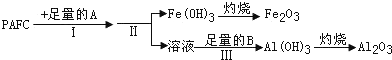
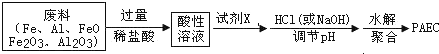
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
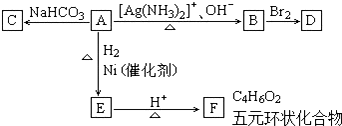
查看答案和解析>>
科目:高中化学 来源: 题型:
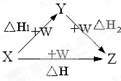
| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、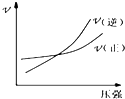 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、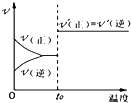 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、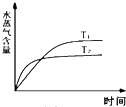 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、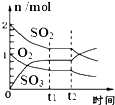 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com