
【题目】下列说法正确的是
A.已知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.碱金属元素都能与氧气反应生成过氧化物
D.单质中不可能含有离子键
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)Cu+2Ag+=2Ag+Cu2+

(1)根据两反应本质,判断能否设计成原电池________________________________________。
(2)如果不能,说明其原因_______________________________________________________________。
(3)如果可以,则写出正、负极材料及其电极反应式和反应类型(“氧化反应“或“还原反应):
负极:___________,__________________________,__________;
正极:___________,__________________________,___________;
若导线上转移电子1mol,则正极质量增加_________g,电解质溶液是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ/mol
③H2O(l)= H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____。
(2)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=272.0kJ/mol
O2(g)=FeO(s) ΔH1=272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是________。铝热反应的反应类型_____,某同学认为,铝热反应可用于工业炼铁,你的判断是_______(填“能”或“不能”),你的理由_________。
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃、101kPa下:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=242kJ/mol
O2(g)=H2O(g) ΔH1=242kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 0.6 molB. 2.8 molC. 1.4 molD. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F与Fe3+生成稳定的FeF63(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I I3(棕黄色)。
ⅳ.I2+2Na2S2O3== 2NaI+Na2S4O6(无色)。
(1)Ⅰ中Cu溶解的离子方程式是__________________________。
(2)Ⅱ中Cu2+和I反应生成CuI白色沉淀和I2。
①加入NH4F溶液的目的是__________________________。
②Cu2+和I反应的离子方程式是_________________________。
③加入过量KI溶液的作用是________________________________。
(3)室温时,CuSCN的溶解度比CuI小。CuI沉淀表面易吸附I2和I3,使测定结果不准确。Ⅲ中,在滴定至终点前加入KSCN溶液的原因是_。
(4)样品中Cu的质量分数为______(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
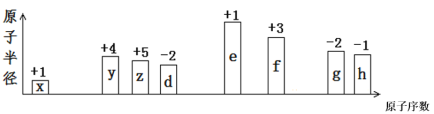
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示)___________________;
(3)z的简单氢化物与z的最高价氧化物的水化物形成的化合物中化学键类型为:_______________________。
(4)元素y的一种同位素可用于测定文物年代,这种同位素原子符号为___________。
(5)元素g与元素h相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________(填序号)。
a.常温下g的单质和h的单质状态不同
b.h的氢化物比g的氢化物稳定
c.一定条件下g和h的单质都能与氢氧化钠溶液反应
d.g、h最高价氧化物对应水化物的酸性前者弱于后者
(6)x、e反应可生成离子化合物ex。
①写出化合物ex的电子式__________________。
②将少量ex投入水中,剧烈反应,得到x单质。
写出反应的化学方程式:_____________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05molL-1的某稀酸H2B溶液中滴入0.1molL-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
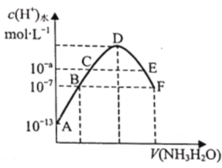
A.NaHB溶液中一定含有H2B分子
B.A、B、C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大
C.E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-)
D.B点溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.1mol钠蒸气与2mol钠蒸气完全燃烧时,燃烧热相同
B.燃烧热是反应热的种类之一
C.在稀溶液中:H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3kJ·mol1,若将含1molHNO3的稀溶液与含1molBa(OH)2的稀溶液混合,放出的热量为57.3kJ
H2O(l) ΔH=57.3kJ·mol1,若将含1molHNO3的稀溶液与含1molBa(OH)2的稀溶液混合,放出的热量为57.3kJ
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8kJ·mol1
2H2O(l) ΔH=+285.8kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com