
����Ŀ��ijͭ�Ͻ���Cu����������Ϊ80%��90%��������Fe�ȡ�ͨ���ü�ӵ������ⶨ����Cu�ĺ������������£�
��ȡa g��Ʒ������ϡH2SO4��H2O2��Һʹ���ܽ⣬��г�ȥ������H2O2����ȴ����ˣ���Һ������250 mL����ƿ�У�
��ȡ50.00 mL��Һ����ƿ�У�����NH4F��Һ��������ҺpHΪ3��4����ַ�Ӧ�������KI��Һ�����ɰ�ɫ��������Һ���ػ�ɫ��
��������ƿ�м���c mol��L1 Na2S2O3��Һ�ζ�������ƿ����ҺΪdz��ɫʱ����������������Һ����������dz��ɫ���ټ���KSCN��Һ������������յ㣻
����ƽ�вⶨ���Σ�����Na2S2O3��Һ�����ƽ��Ϊv mL������ͭ������������
��֪������F��Fe3+�����ȶ���FeF63����ɫ����
����I2��ˮ���ܽ��С���ӷ���
����I2+I I3���ػ�ɫ����
����I2+2Na2S2O3== 2NaI+Na2S4O6����ɫ����
(1)����Cu�ܽ�����ӷ���ʽ��__________________________��
(2)����Cu2+��I��Ӧ����CuI��ɫ������I2��
�ټ���NH4F��Һ��Ŀ����__________________________��
��Cu2+��I��Ӧ�����ӷ���ʽ��_________________________��
�ۼ������KI��Һ��������________________________________��
(3)����ʱ��CuSCN���ܽ�ȱ�CuIС��CuI��������������I2��I3��ʹ�ⶨ�����ȷ�����У��ڵζ����յ�ǰ����KSCN��Һ��ԭ����_��
(4)��Ʒ��Cu����������Ϊ______(�г�����ʽ)��
���𰸡�Cu+H2O2+2H+=Cu2++2H2O ����Һ�е�Fe3+ת��ΪFeF63����ֹ������I 2Cu2++4I=2CuI��+I2 ��Cu2+��ֻ�ԭΪCuI��I��I2�������I3������I2�Ļӷ� ��CuI����ת��Ϊ�ܽ�ȸ�С��CuSCN�������ͷų�������I2��I3����߲ⶨ�����ȷ�̶� (63.5��5��cv��103��![]() )��100%
)��100%
��������
(1)����Cu�����������±�˫��ˮ��������ͭ���Ӻ�ˮ��
(2)��������Ʒ�к������������ʣ������������±��ܽ�Ϊ�����ӣ������Ӿ���������Ҳ����I��Ӧ��Ӱ��Cu�����ⶨ��ȷ�ԣ�
�ڸ������⣬Cu2+��I��ӦCuI��ɫ������I2��
�ۼ������KI��Һ��ȷ����Cu2+��ֻ�ԭΪCuI�����Cu�����ⶨ��ȷ�ԣ�
(3)����ʱ��CuSCN���ܽ�ȱ�CuIС������KSCN��Һ��ʹ��������ת�����ͷų�������������I2��I3��
(4)����2Cu2++4I=2CuI��+I2��I2+2Na2S2O3= 2NaI+Na2S4O6�ɵã�2Cu2+~ I2~ Na2S2O3�����ݵζ�����Na2S2O3����Cu2+�����ʵ������ټ�����Ʒ��Cu������������
(1)����Cu�����������±�˫��ˮ��������ͭ���Ӻ�ˮ�����ӷ�Ӧ����ʽΪ��Cu+H2O2+2H+=Cu2++2H2O��
(2)��������Ʒ�к������������ʣ������������±��ܽ�Ϊ�����ӣ������Ӿ���������Ҳ����I��Ӧ����������I�ĺ������ʹCu�����ⶨ��ȷ���������⣬F��Fe3+�����ȶ���FeF63(��ɫ)������NH4F��Һ��Ŀ���ǽ���Һ�е�Fe3+ת��ΪFeF63����ֹ������I��ȷ��Cu�����ⶨ��ȷ�ԣ�
�ڸ������⣬Cu2+��I��ӦCuI��ɫ������I2�����ӷ���ʽΪ��2Cu2++4I=2CuI��+I2��
�ۼ������KI��Һ��ȷ����Cu2+��ֻ�ԭΪCuI��ͬʱ������KI��Һ�ɷ���I2+I I3��I��I2�������I3������I2�Ļӷ������Cu�����ⶨ��ȷ�ԣ�
(3)������ʱ��CuSCN���ܽ�ȱ�CuIС������KSCN��Һ����CuI����ת��Ϊ�ܽ�ȸ�С��CuSCN������ת���������ͷų�������I2��I3��I2��ֱ��ζ�����߲ⶨ�����ȷ�̶ȣ�
(4)����2Cu2++4I=2CuI��+I2��I2+2Na2S2O3=2NaI+Na2S4O6�ɵã�2Cu2+~ I2~ Na2S2O3���ζ�50.00mL��Һ����������n(Na2S2O3)=cmol��L1��v��10-3L=cv��10-3mol����n(Cu)= n(Cu2+)= 2n(Na2S2O3)=2cv��10-3mol������Ʒ��Cu����������Ϊ= =(63.5��5��cv��103��
=(63.5��5��cv��103��![]() )��100%��
)��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij������N2��H2��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ���ǣ�������
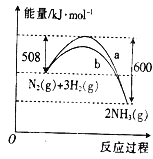
A. �÷�Ӧ���Ȼ�ѧ����ʽΪN2��g��+3H2��g��![]() 2NH3��g�� ��H=+92kJ��mol��1
2NH3��g�� ��H=+92kJ��mol��1
B. a�����Ǽ������ʱ�������仯����
C. ����������û�ѧ��Ӧ�ķ�Ӧ����ֵ���С
D. ��Ӧ2NH3��g��![]() N2��g��+3H2��g����H=+92kJ��mol��1
N2��g��+3H2��g����H=+92kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ��ܱ���ϵ�У����淴Ӧ��A(s)��2B(g)![]() 2C(g)����H<0��������Ϊ�÷�Ӧ�ﵽ��ѧƽ��ı�־����
2C(g)����H<0��������Ϊ�÷�Ӧ�ﵽ��ѧƽ��ı�־����
��v��(B)��v��(C) ��n(B)��n(C)��1��1 ��������ѹǿ���ٸı�
��������������ܶȲ��ٸı� �������ڻ�������ƽ����Է����������ٸı�
A. �ڢۢܢ� B. �٢ۢ� C. �ڢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȵĹ��嵥��M����Ũ�����У����ҷ�Ӧ�������������A��A�ڳ����²�������Ӵ�ʱ��������ͼ��ʾ�ı仯��

(1)�������A����Ҫ�ɷ���____________��
(2)����BΪ__________����ɫ��ҺDΪ____________��
(3)����M��Ũ���ᷴӦ�Ļ�ѧ����ʽ��____________________________��
(4)����C��ϡ���ᷴӦ�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��֪2C��SiO2![]() Si��2CO����˵��Si�ķǽ����Ա�Cǿ
Si��2CO����˵��Si�ķǽ����Ա�Cǿ
B.���Ӳ���Խ�࣬ԭ�Ӱ뾶һ��Խ��
C.�����Ԫ�ض�����������Ӧ���ɹ�������
D.�����в����ܺ������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ܱ������з�����ӦaX(g) ![]() bY(g)��cZ(g)���ﵽƽ������¶Ȳ��䣬���������ݻ�ѹ����ԭ���ݻ���һ�룬���ﵽ��ƽ��ʱ������Y��Z��Ũ�Ⱦ���ԭ����1.8����������������ȷ����
bY(g)��cZ(g)���ﵽƽ������¶Ȳ��䣬���������ݻ�ѹ����ԭ���ݻ���һ�룬���ﵽ��ƽ��ʱ������Y��Z��Ũ�Ⱦ���ԭ����1.8����������������ȷ����
A. ���淴Ӧ�Ļ�ѧ��������a��b��c
B. �ﵽ��ƽ��ʱ������X��ת���ʼ�С
C. ѹ���������ݻ�ʱ���������������С
D. �ﵽ��ƽ��ʱ���������Z��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����2�ֱ�ΪA�ڼס�����������������ƽ����ϵA(g)+B(g)![]() C(g)��2A(g)
C(g)��2A(g)![]() B(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����
B(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����
A. ��1����2����СB. ��1����2������C. ��1��С����2����D. ��1������2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������I�̶��������������������ƶ���M��N���������о�������Ӧ��A(g)+2B(g)![]() xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )
xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )

A. ��x=3���ﵽƽ���A�����������ϵΪ����(M)����(N)
B. ��x��3���ﵽƽ���B��ת���ʹ�ϵΪ����(M)����(N)
C. ��x��3��C��ƽ��Ũ�ȹ�ϵΪ��c(M)��c(N)
D. x����Ϊ��ֵ����ʼʱ��N�����г�������ֵ��C��ƽ���N������A��Ũ�Ⱦ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ��(�г��豸����)
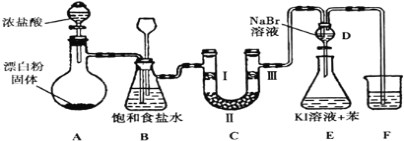
(1)װ��A�������ķ���װ�ã�Ũ�������Ư�۵���Ч�ɷַ�Ӧ������������д����Ӧ��Ӧ�Ļ�ѧ����ʽ��__________________________________��װ��A��������װƯ�۵�����������____________��
(2)װ��B�б���ʳ��ˮ��������___________________________��ͬʱװ��BҲ�ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д��C�з�������ʱB�е�����_________ ��
(3)װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η������ʵ����Ӧ��___________(����ĸ���)��
��� | �� | �� | �� |
a | �������ɫ���� | ��ʯ�� | ʪ�����ɫ���� |
b | �������ɫ���� | ��ˮ����ͭ | ʪ�����ɫ���� |
c | ʪ�����ɫ���� | Ũ���� | �������ɫ���� |
d | ʪ�����ɫ���� | ��ˮ�Ȼ��� | �������ɫ���� |
(4)���װ��D��E��Ŀ����֤������ǿ��˳��Cl2 >Br2 >I2����Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽��������_____________________��������______(������������������)˵���嵥�ʵ�������ǿ�ڵ⣬ԭ����________________��
(5)װ��F��������___________�����ձ��е���Һ����ѡ�������е�____________(����ĸ���)��
a������NaOH��Һ b������NaCl��Һ
c������Na2SO3��Һ d������Na2CO3��Һ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com