
| A、常温常压下,1mol乙烯共用电子对数为4NA |
| B、1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA |
| C、标准状况下,1L戊烷充分燃烧后生成气态产物的分子数为5/22.4 NA |
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA |
| ||


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
| A、1×10-4mol/L |
| B、1×10-10mol/L |
| C、(1×10-4-1×10-10)mol/L |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应Ⅰ:△H>0,P2>P1 |
| B、反应Ⅱ:△H>0,T1<T2 |
| C、反应Ⅲ:△H<0,T2>T1 |
| D、反应Ⅳ:△H>0,T2>T1;或△H<0,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:丁>丙>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用明矾净水的好处是杀菌、消毒,吸附水中的悬浮物 |
| B、减少使用氟氯代烃的目的是为了减少酸雨 |
| C、大量开采地下水,矿产资源,以满足社会经济发展的需求 |
| D、氢燃料汽车的使用,可以有效减少城市空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、58.5g氯化钠中约含有6.02×1023个氯化钠分子 |
| B、含有2NA个阴离子的CaC2,在标准状况下,能产生约44.8L的乙炔气体 |
| C、在含4mol Si-O键的石英晶体中,氧原子的数目为4NA |
| D、12.5mL 16mol?L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3的摩尔质量为48g/mol |
| B、物质的量的单位是克 |
| C、1mol单质碳在任何条件下的体积都为22.4L |
| D、将2molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质.
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质.- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
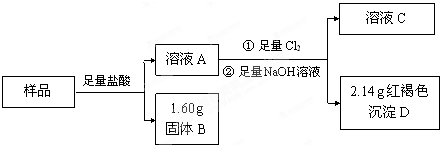
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com