
| A.H2CO3?2H++CO32- |
| B.NaHSO4(溶液)=Na++H++SO42- |
| C.NaHCO3=Na++HCO3- |
| D.CaCO3=Ca2++CO32- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4=2H++SO4-2 | B.NaOH=Na++O2-+H+ |
| C.Na2CO3=2Na++CO32- | D.Ca(NO3)2=Ca2++(NO3)22- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3═2Na++CO32- | B.H2SO4═2H++SO42- |
| C.Ca(OH)2═Ca2++2(OH)- | D.FeCl3═Fe3++3Cl- |
| E.FeCl3═Fe3++3Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCl2=Ca2++Cl2- | B.NaOH=Na++H++O2- |
| C.HNO3=H++NO3- | D.K2CO3=K++CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3?H2O?NH4++OH- | B.H2CO3?2H++CO32- |
| C.NaHCO3?Na++H++CO32- | D.HCl?H++Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2 HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4 H+ + ClO- Ka=?
H+ + ClO- Ka=?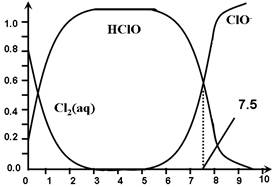
A.Cl2(g)+ H2O  2H+ + ClO- + Cl- K=10-10.9 2H+ + ClO- + Cl- K=10-10.9 |
| B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com