
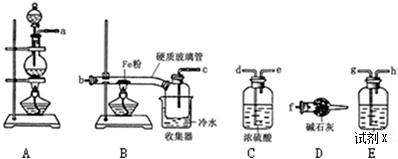
分析 实验室用浓盐酸与二氧化锰加热制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去氯化氢和水蒸气,得到纯净干燥的氯气,铁在氯气中燃烧生成氯化铁.
(1)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢与氯气在饱和食盐水中溶解度不同,选择饱和食盐水除杂;氯气有毒,能与碱反应,可以用碱石灰吸收过量的氯气;
(3)Fe在氯气中燃烧生成棕褐色烟,导气管口较细,易堵塞;
(4)利用生成的氯气排出装置中的空气来分析;
(5)氯化铁为强酸弱碱盐,溶于水,三价铁离子水解生成氢氧化铁和氯化氢;
解答 解:(1)实验室用浓盐酸与二氧化锰加热制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水,浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,
故答案为:g;h;d;e;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶液水,而氯气在饱和食盐水中溶解度很小,所以选择饱和食盐水除去氯气中的氯化氢;氯气有毒,能与碱反应,可以用碱石灰吸收过量的氯气;
故答案为:故答案为:吸收过量的氯气;饱和食盐水;
(3)Fe在氯气中燃烧生成棕褐色烟,棕褐色烟冷却易生成固体,导气管口较细,易堵塞,所以硬质玻璃管与收集器之间没有用导管连接,
故答案为:防止堵塞;
(4)B中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以B中的反应开始前,必须排除装置中的空气,其方法是A中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热B,
故答案为:A中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热B;
(5)氯化铁为强酸弱碱盐,溶于水,三价铁离子水解生成氢氧化铁和氯化氢,溶液显酸性;
故答案为:酸性.
点评 本题考查了制备实验方案中的有关知识,难度不大,明确氯气制备原理及性质是解题关键,侧重考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
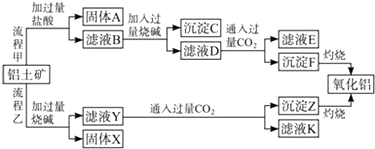
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
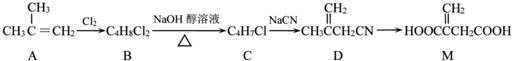
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$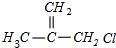 +NaCl+H2O,其反应类型为消去反应.
+NaCl+H2O,其反应类型为消去反应.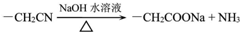 ,D经五步转成变成M的合成反应流程为:
,D经五步转成变成M的合成反应流程为: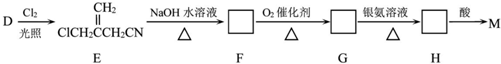
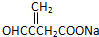 ;
;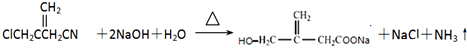 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com