
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A.b的离子为Cl-
B.溶液中含有NA个Na+
C.水合b离子的图示不科学
D.40℃时该溶液的pH小于7,是由于Na+水解所致
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】W、Y、Z为常见短周期元素,三种元素分属不同周期不同主族,且与X能形成如图结构的化合物。已知W、Y、Z的最外层电子数之和等于X的核外电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
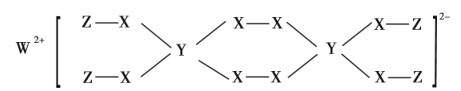
A.对应元素形成的气态氢化物稳定性:Y>X
B.W、X对应的简单离子半径顺序为:X>W
C.Y的氧化物对应水化物为强酸
D.该化合物中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是( )
A. 验证化学能转化为电能
验证化学能转化为电能
B. 证明温度对平衡移动的影响
证明温度对平衡移动的影响
C. 验证铁发生析氢腐蚀
验证铁发生析氢腐蚀
D. 验证AgCl溶解度大于Ag2S
验证AgCl溶解度大于Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如图所示。请写出生成沉淀的离子方程式___。
![]()
(2)滤渣Ⅱ的主要成分是:___(填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___。
(4)写出在高温下生成磷酸亚铁锂的化学方程式:___。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:___。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为___。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:___。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下,下列有关该有机物的叙述中不正确的是
![]()
A. 其分子式为 C9H10O
B. 能使酸性高锰酸钾溶液褪色
C. 一定条件下,1mol 该有机物理论上最多能与 4mol H2 发生加成反应
D. 一定条件下,1mol 该有机物理论上最多能与 4mol Br2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据都表示合成氨的反应速率,其中速率相等的是( )
①![]() (N2)=0.6mol/(L·min) ②
(N2)=0.6mol/(L·min) ②![]() (NH3)=1.8mol/(L·min)
(NH3)=1.8mol/(L·min)
③![]() (H2)=1.2mol/(L·min) ④
(H2)=1.2mol/(L·min) ④![]() (H2)=0.045mol/(L·s)
(H2)=0.045mol/(L·s)
A. ①②B. ①③C. ③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学向做过银镜反应的试管滴加0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学认为:Fe3+具有氧化性,能够溶解单质Ag。
乙同学认为:Fe(NO3)3溶液显酸性,该条件下NO3-也能氧化单质Ag。
丙同学认为:Fe3+和NO3-均能把Ag氧化而溶解。
(1)生成银镜反应过程中银氨溶液发生_____________(氧化、还原)反应。
(2)为得出正确结论,只需设计两个实验验证即可。
实验I:向溶解了银镜的Fe(NO3)3的溶液中加入____________(填序号,①KSCN溶液、②K3[Fe(CN)6]溶液、③稀HC1),现象为___________,证明甲的结论正确。
实验Ⅱ:向附有银镜的试管中加入______________溶液,观察银镜是否溶解。
两个实验结果证明了丙同学的结论。
(3)丙同学又把5mLFeSO4溶液分成两份:第一份滴加2滴KSCN溶液无变化;第二份加入1mL0.1mol/LAgNO3溶液,出现白色沉淀,随后有黑色固体产生(经验证黑色固体为Ag颗粒),再取上层溶液滴加KSCN溶液变红。根据上述的实验情况,用离子方程式表示Fe3+、Fe2+、Ag+、Ag之间的反应关系_______________。
(4)丁同学改用如图实验装置做进一步探究:

①K刚闭合时,指针向左偏转,此时石墨作_________,(填“正极”或“负极。此过程氧化性:Fe3+_______Ag+(填>或<)。
②当指针归零后,向右烧杯中滴加几滴饱和AgNO3溶液,指针向右偏转。此过程氧化性:Fe3+_______Ag+(填>或<)。
③由上述①②实验,得出的结论是:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,已知:N2(g)+3H2(g)
分别表示N2、H2、NH3,已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
下列说法正确的是( )

A.使用催化剂,合成氨反应放出的热量减少
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。已知:K1000℃>K800℃,则该反应是__反应。(填“吸热”或“放热”);
(2)已知在800℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=___。
CO2(g)+H2(g)的平衡常数K2=___。
(3)能判断该反应是否达到化学平衡状态的依据是__。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为__℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com