
分析 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素,以此解答该题.
解答 解:(1)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,
故答案为:sp;3NA;
(2)氨气中存在氢键,甲烷中不存在氢键,氢键的存在导致氨气的沸点升高,所以化合物NH3的沸点比化合物CH4的高,
故答案为:氨气中存在氢键、甲烷中不存在氢键;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(4)硫酸铜溶液呈蓝色,原因是溶液中存在[Cu(NH3)4]2+,向硫酸铜水溶液中逐滴加入足量氨水,发现先生成蓝色沉淀,然后沉淀溶解,得到深蓝色透明溶液,沉淀溶解的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.若沉淀溶解后的溶液中加入乙醇,则析出[Cu(NH3)4]SO4•H2O固体,含有离子键、共价键,
故答案为:[Cu(NH3)4]2+;先生成蓝色沉淀而后沉淀溶解;[Cu(NH3)4]SO4•H2O;离子键、共价键.
点评 本题考查了元素位置结构性质的相互关系及应用,为高考常见题型,涉及氢键、原子杂化方式的判断等知识点,这些知识点都是考试热点,灵活运用基本知识来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用氨制碳酸氢铵 | B. | 制普通玻璃 | ||
| C. | 用铁矿石炼铁 | D. | 汽车用乙醇汽油作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
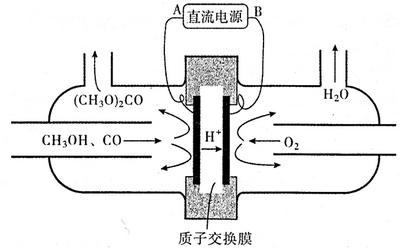
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为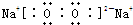 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
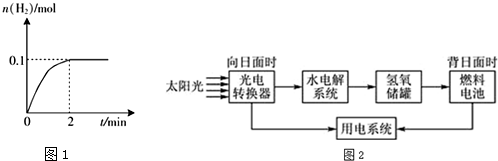
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com