
| ������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| �� | 387 | 0.20 | x | |
| �� | 387 | 0.40 | y | |
| �� | 207 | 0.20 | 0.090 | 0.090 |
���� ��1����֪���٣�C��s��+O2��g���TCO2��g����H=-393.5kJ/mol��
�ڣ�2H2��g��+O2��g���T2H2O��g����H=-483.6kJ/mol��
�ۣ�CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-283.0kJ/mol��
���ݸ�˹���ɣ���-�ڡ�$\frac{1}{2}$-�ۿɵã�C��s��+H2O��g���TCO��g��+H2��g������Ӧ��Ҳ������Ӧ���㣻
��2��ƽ�ⳣ��KΪ��Ӧ�ﵽƽ��ʱ����v��=v����
��3���٢��ЧΪ��I�Ļ�����ѹǿ����һ������Ӧǰ������������䣬ƽ�ⲻ�ƶ�����Ӧ��ת���ʲ��䣻
�ڼ���Ũ����Qc����ƽ�ⳣ���Ƚϣ���Qc=K������ƽ��״̬����Qc��K����Ӧ���淴Ӧ���У���Qc��K����Ӧ������Ӧ���У�
�ۼ���207��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ������387��ʱƽ�ⳣ��K=4�Ƚϣ��жϷ�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ��Ӧ�ı��¶�ʹ����ƽ�������ƶ���
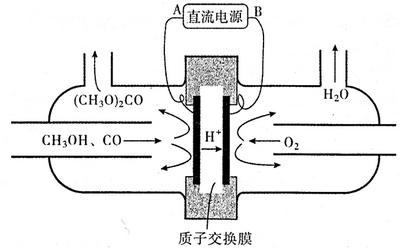
��4���ɽṹʾ��ͼ��֪����������������Ӧ���Ҳ����ԭ��Ӧ����������Ϊ���������ӵ�Դ���������Ҳ�Ϊ���������ӵ�Դ�ĸ����������Ǽ״���COʧȥ�������ɣ�CH3O��2CO�������ӣ�
��5�������ʱ��Һ�б�����Ũ����̼���Ũ�ȵij˻�����¶���̼�ᱵ���ܶȻ������Ƚϼ��ɣ�
��� �⣺��1����֪����C��s��+O2��g���TCO2��g����H=-393.5kJ/mol��
��2H2��g��+O2��g���T2H2O��g����H=-483.6kJ/mol��
��CO��g��+$\frac{1}{2}$ O2��g���TCO2��g����H=-283.0kJ/mol��
���ݸ�˹���ɣ���-�ڡ�$\frac{1}{2}$-�ۿɵã�C��s��+H2O��g���TCO��g��+H2��g����
�ʡ�H=-393.5kJ/mol-��-483.6kJ/mol����$\frac{1}{2}$-��-283kJ/mol��=+131.3 kJ/mol��
�ʴ�Ϊ��+131.3 kJ/mol��
��2��ƽ�ⳣ��K=$\frac{c��C{O}_{2}��•c��O��}{c��CO��•c��{O}_{2}��}$=$\frac{{k}_{��}}{{k}_{��}}$=$\frac{1.21��1{0}^{5}L/mol}{3.02��1{0}^{5}L/mol}$=0.40���ʴ�Ϊ��0.40��
��3���٢��ЧΪ��I�Ļ�����ѹǿ����һ������Ӧǰ������������䣬ƽ�ⲻ�ƶ�����Ӧ��ת���ʲ��䣬��ת����Ϊa����x=2a��y=4a����$\frac{x}{y}$=$\frac{1}{2}$��
�ʴ�Ϊ��$\frac{1}{2}$��
��Ũ����Qc=$\frac{0.15��0.1}{0��{1}^{2}}$=1.5��K=4���ʷ�Ӧ������Ӧ���У�
�ʴ�Ϊ������
��207��ʱ��ƽ��ʱ������ˮ��Ϊ0.09mol�������ĵļ״�Ϊ0.18mol��ƽ��ʱ�״�Ϊ0.02mol����ƽ�ⳣ��K=$\frac{0.09��0.09}{0.0{2}^{2}}$=20.25������387��ʱƽ�ⳣ����˵�������¶�ƽ��������Ӧ���У�������ӦΪ���ȷ�Ӧ���������з�Ӧ�ﵽƽ�����Ҫ��һ������ѵIJ��ʣ������¶ȷ���Ĵ�ʩΪ�������¶ȣ�
�ʴ�Ϊ��B��
��4���ɽṹʾ��ͼ��֪����������������Ӧ���Ҳ����ԭ��Ӧ����������Ϊ���������ӵ�Դ���������Ҳ�Ϊ���������ӵ�Դ�ĸ�����BΪ��Դ�ĸ����������Ǽ״���COʧȥ�������ɣ�CH3O��2CO�������ӣ��缫��ӦʽΪ��2CH3OH+CO-2e-=��CH3O��2CO+2H+��
�ʴ�Ϊ��B��2CH3OH+CO-2e-=��CH3O��2CO+2H+��
��5��������Һ�������Ϻ���Һ�б�����Ũ��=$\frac{0.2mol/L}{2}$=0.1mol/L��0.1 mol•L-1 NaHC03��Һ�������c��CO32-��Ϊ0.0011 mol•L-1����Q=Q=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9���ʻ����������
��Q=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9��
���� ���⿼�����ø�˹���ɼ��㷴Ӧ�ȣ���ѧƽ�������Ӱ�����ء���Ӧ�ȼ��㡢�绯ѧ�ȣ����ؿ���ѧ����������������ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ����±������NaOHˮ��Һ���ȣ���ȴ���ټ�AgNO3��Һ����±ԭ�Ӵ��� | |
| B�� | ������ϩ����ʹ��ˮ��ɫ������ɫ��ԭ���Dz�ͬ�� | |
| C�� | ����ˮ���Լ�����ϩ����Ȳ | |
| D�� | ���ͱ���ͬϵ�ﶼ���������Ը��������Һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | �ж� |
| A | �ֱ�������ʯ��ˮ | ����������ΪNa2CO3 |
| B | �ֱ�����Ũ�ȵ�ϡ���� | ��Ӧ�Ͼ�����ΪNa2CO3 |
| C | �ֱ����CaCl2��Һ | ����������ΪNa2CO3 |
| D | �����Ũ�ȵ����� | ��������������ΪNa2CO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 A��B��C��D��E��F����ѧ��ѧ�г��������ֶ�����Ԫ�أ��й�λ�ü���Ϣ���£�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C������ʵ����һ�㱣����ú���У�F������������Ӧ��ˮ����������ᷴӦ������Ӧ��G�������ճ��������������Ľ������ױ���ʴ����ش��������⣺
A��B��C��D��E��F����ѧ��ѧ�г��������ֶ�����Ԫ�أ��й�λ�ü���Ϣ���£�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C������ʵ����һ�㱣����ú���У�F������������Ӧ��ˮ����������ᷴӦ������Ӧ��G�������ճ��������������Ľ������ױ���ʴ����ش��������⣺| �� | E | A | B | ||
| C | �� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ٴ���5������ | |
| B�� | Cl-һ�����ڣ���c��Cl-����0.2mol/L | |
| C�� | SO42-��NH4+��Fe3+һ�����ڣ�Al3+��K+��Cl-���ܴ��� | |
| D�� | CO32-һ�������ڣ�SO42-��NH4+��Fe3+��Cl-һ������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com