
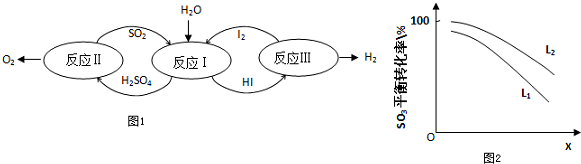
���� ��1����ͼ��֪����ӦIΪ����������ⷢ��������ԭ��Ӧ���������HI��
��2���ٷֳ����㣬���ܽ��ԡ��ܶ��йأ�
�ڸ����������ữ���Ȼ�����Һ�����ϲ���Һ�е�SO42-���������Һ��
��H2SO4��c��H+����c��SO42-��=2.06��1����HI����������ӣ�
��3������ͼ��֪��XԽ��ת����Խ�ͣ�
�ڷֽⷴӦΪ���ȷ�Ӧ���¶ȸߣ�ת���ʴ�
��� �⣺��1����ͼ��֪����ӦIΪ����������ⷢ��������ԭ��Ӧ���������HI���÷�ӦΪSO2+2H2O+I2=H2SO4+2HI���ʴ�Ϊ��SO2+2H2O+I2=H2SO4+2HI��
��2����a��������Һ���ܶȴ��ڲ�ų������²㣬��a��ȷ��
b����I2ǰ��H2SO4��Һ��HI��Һ���ܣ���ֲ��أ���b����
c��I2��HI��Һ�б���H2SO4��Һ�����ܣ�����ڲ�ͬ�ܼ����ܽ��Բ�ͬ��������ȡ����ֲ��йأ���c��ȷ��
�ʴ�Ϊ��ac��
����Ϊ��Һ�ֳɺ���Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㣬����������Һ�ķ������������ữ���Ȼ�����Һ�����ϲ���Һ�е�SO42-���ʴ�Ϊ���������ữ���Ȼ�����Һ�����ϲ���Һ�е�SO42-��
��H2SO4����c��H+����c��SO42-��=2.06��1�����ֵ����2��ԭ����������к�������I2��I2+H2O=HI+HIO����HI����������ӣ��ʴ�Ϊ��������к�������I2��I2+H2O=HI+HIO����HI����������ӣ�
��3������ͼ��֪��XԽ��ת����Խ�ͣ������¶�ת����������X��ʾѹǿ���ʴ�Ϊ��ѹǿ��
����SO3��g��=SO2��g��+O2��g����H��0���¶ȸߣ�ת���ʴ�ͼ�е�ѹǿʱL2��Ӧ��ת���ʴ���L1��L2���ʴ�Ϊ��L1��L2���ֽⷴӦΪ���ȷ�Ӧ���¶ȸߣ�ת���ʴ�
���� ���⿼����������ᴿ����ѧƽ��ȣ�Ϊ��Ƶ���㣬���շ����ķ�Ӧ��ƽ��Ӱ������Ϊ���Ĺؼ������ط�����Ӧ���������ۺϿ��飬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHSO4��Һ | B�� | KOH��Һ | C�� | Na2SO4 | D�� | NH4Cl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ѹǿ����ʱ��仯 | B�� | ��ѧ��Ӧ���ʹ�ϵ�ǣ�2������X��=������Y�� | ||
| C�� | �����������ܶȲ���ʱ��仯 | D�� | ������X��Y��Z��Ũ��֮��Ϊl��2��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ԣ�A��=0.5mol/��L•min�� | B�� | �ԣ�B��=1.2mol/��L•s�� | C�� | �ԣ�C��=0.1mol/��L•s�� | D�� | �ԣ�D��=0.4mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
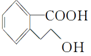 �������й�M��˵����ȷ���ǣ�������
�������й�M��˵����ȷ���ǣ�������| A�� | �÷����д���һ������̼ԭ�� | |
| B�� | M�ķ���ʽΪC9H10O3 | |
| C�� | 1 mol M��������Na��Ӧ����0.5 mol H2 | |
| D�� | 1 mol M��ȫȼ������10 mol O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| �� | 387 | 0.20 | x | |
| �� | 387 | 0.40 | y | |
| �� | 207 | 0.20 | 0.090 | 0.090 |
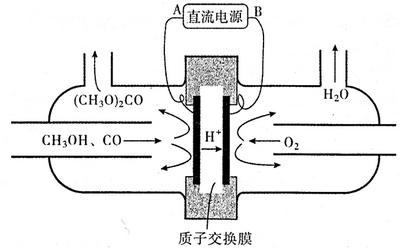
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
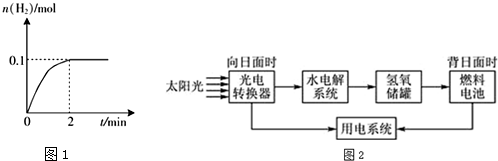
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
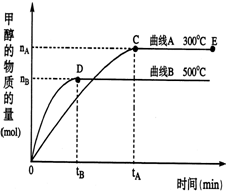 һ�������£������Ϊ2L���ܱ������У�һ����̼�������ڴ������÷�Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g������������������и��⣺
һ�������£������Ϊ2L���ܱ������У�һ����̼�������ڴ������÷�Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g������������������и��⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com