
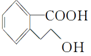
 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | 操作 | 判断 |
| A | 分别加入澄清石灰水 | 产生沉淀者为Na2CO3 |
| B | 分别加入等浓度的稀盐酸 | 反应较剧烈者为Na2CO3 |
| C | 分别加入CaCl2溶液 | 产生沉淀者为Na2CO3 |
| D | 逐渐加入等浓度的盐酸 | 立即产生气泡者为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
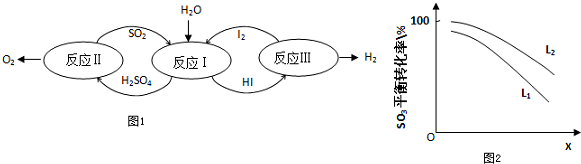
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
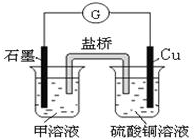 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
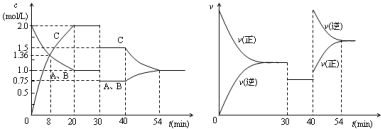
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com