
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
分析 ①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为BaCO3和BaSO4,则溶液中含有CO32-、SO42-;
②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+;
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰,说明溶液中含有K+,但加入KOH,不能确定原溶液中是否含有,以此解答该题.
解答 解:①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,说明白色沉淀为BaCO3和BaSO4,则溶液中含有CO32-、SO42-;
②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+;
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰,说明溶液中含有K+,但加入KOH,不能确定原溶液中是否含有,
不能确定是否含有Na+、Cl-,
则一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl-,
故选D.
点评 本题考查常见离子的检验方法,为高考常见题型和高频考点,题目难度中等,注意掌握常见离子的化学性质及检验方法,明确检验离子是否存在时,排除干扰离子,确保检验方案的严密性.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | ②①③⑧⑦⑥⑤④ | B. | ②①③⑥⑦⑧⑤④ | C. | ①②③⑧⑦⑥④⑤ | D. | ②①⑧③⑦⑥④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m=2 | |
| B. | 达平衡时,Z的体积分数为10% | |
| C. | 达平衡后,保持容器体积不变,加热,容器内压强将增大 | |
| D. | 将平衡后的容器体积压缩至1L,X的浓度为0.45mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 | |
| B. | 苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在1000时即可生成三硝基甲苯,说明苯环对甲基产生了影响 | |
| C. | 福尔马林(甲醇的水溶液)是混合物,可用来制作生物标本 | |
| D. | 除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,然后分液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | B. | 化学反应速率关系是:2υ正(X)=υ正(Y) | ||
| C. | 容器内气体密度不随时间变化 | D. | 容器内X、Y、Z的浓度之比为l:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
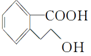 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
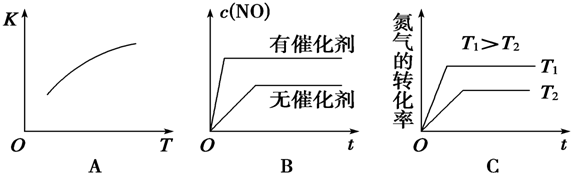
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com