
分析 有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒则$\frac{2.4g}{xg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2,解得x=24,故C的质子数为24-12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素,以此解答该题.
解答 解:(1)由上述分析可知,A是氧、B是钠、C是镁、D是氯,
故答案为:氧;钠;镁;氯;
(2)B、C、D最高价氧化物的水化物化学式分别为NaOH、Mg(OH)2、HClO4,故答案为:NaOH;Mg(OH)2;HClO4;
(3)D的气态氢化物为HCl,非金属性F>Cl>S,故氢化物稳定性H2S<HCl<HF,故答案为:H2S<HCl<HF.
点评 本题考查结构性质位置关系的应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,比较基础,推断元素是解题关键,注意元素周期律的理解掌握.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | m=2 | |
| B. | 达平衡时,Z的体积分数为10% | |
| C. | 达平衡后,保持容器体积不变,加热,容器内压强将增大 | |
| D. | 将平衡后的容器体积压缩至1L,X的浓度为0.45mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
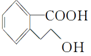 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
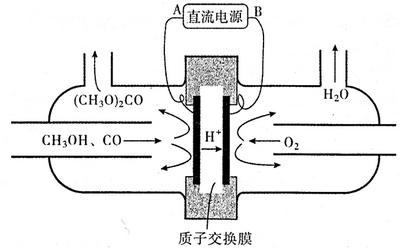
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
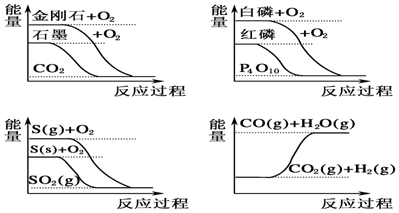
| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | 石墨转变为金刚石是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com