
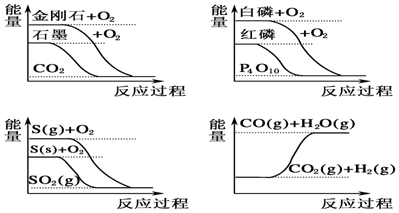
| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | 石墨转变为金刚石是吸热反应 |
分析 A.由图可知,CO2(g)、H2(g)的总能量小于CO(g)、H2O(g)的总能量;
B.生成物相同,反应物中气态S的能量大于固态S的能量;
C.由图可知,生成物相同,反应物中白磷能量高于红磷能量;
D.由图可知,金刚石的能量高于石墨的能量.
解答 解:A.由图可知,CO2(g)、H2(g)的总能量小于CO(g)、H2O(g)的总能量,则CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,故A错误;
B.生成物相同,反应物中气态S的能量大于固态S的能量,则S(g)+O2(g)═SO2(g)放出热量多,焓变为负,可知△H1<△H2,故B错误;
C.由图可知,生成物相同,反应物中白磷能量高于红磷能量,则红磷比白磷稳定,故C错误;
D.由图可知,金刚石的能量高于石墨的能量,则石墨转变为金刚石是吸热反应,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、反应中能量变化的关系为解答关键,侧重分析与应用能力的考查,注意能量低的物质更稳定,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
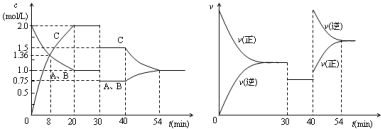
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠和稀硫酸反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
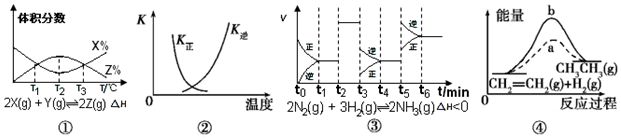
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
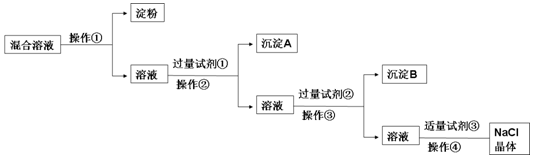
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com