
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
分析 某溶液可能含有Cl-、SO42-、CO32-、HCO3-、NH4+、Fe3+、Ba2+和K+,取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,判断为氨气,NH4++OH-=NH3↑+H2O,溶液中一定含NH4+,物质的量为0.02mol,同时产生1.97g白色沉淀,分析可知溶液中一定含Ba2+,则一定不含SO42-、CO32-、Fe3+,白色沉淀为BaCO3,是碳酸氢根离子和氢氧化钠反应生成碳酸根离子结合钡离子生成的碳酸钡白色沉淀,向上述滤液中加足量BaCl2溶液,也得到1.97g沉淀是碳酸钡沉淀,则碳酸氢根离子物质的量=$\frac{1.97g}{197g/mol}$+$\frac{1.97g}{197g/mol}$=0.02mol,原溶液中Ba2+物质的量=$\frac{1.97g}{197g/mol}$=0.01mol,结合溶液中电荷守恒分析判断其他离子是否存在,阳离子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,则一定含Cl-物质的量最少为0.02mol,K+可能含有,分析选项分析判断.
解答 解:某溶液可能含有Cl-、SO42-、CO32-、HCO3-、NH4+、Fe3+、Ba2+和K+,取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,判断为氨气,NH4++OH-=NH3↑+H2O,溶液中一定含NH4+,物质的量为0.02mol,同时产生1.97g白色沉淀,分析可知溶液中一定含Ba2+,则一定不含SO42-、CO32-、Fe3+,白色沉淀为BaCO3,是碳酸氢根离子和氢氧化钠反应生成碳酸根离子结合钡离子生成的碳酸钡白色沉淀,向上述滤液中加足量BaCl2溶液,也得到1.97g沉淀是碳酸钡沉淀,则碳酸氢根离子物质的量=$\frac{1.97g}{197g/mol}$+$\frac{1.97g}{197g/mol}$=0.02mol,原溶液中Ba2+物质的量=$\frac{1.97g}{197g/mol}$=0.01mol,结合溶液中电荷守恒分析判断其他离子是否存在,阳离子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,则一定含Cl-物质的量最少为0.02mol,K+可能含有,
A.分析可知一定含有的离子HCO3-、NH4+、Ba2+和Cl-,可能含K+,所以溶液中至少存在4种离子,故A错误;
B.依据溶液中电荷分析可知,阳离子:n(NH4+)+2n(Ba2+)=0.02mol+2×0.02mol=0.06mol,n(HCO3-)=0.02mol,则一定含Cl-物质的量最少为0.02mol,Cl-一定存在,K+离子可能含有,氯离子浓度最少为:c(Cl-)≥$\frac{0.02mol}{0.1L}$=0.2mol/L,故B正确;
C.SO42-、Fe3+一定不存在,K+、Cl-可能存在,NH4+一定存在,故C错误;
D.CO32-一定不存在,HCO3-、NH4+、Ba2+和Cl-一定存在,SO42-、Fe3+一定不存在,故D错误;
故选B.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,题目难度中等,试题侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
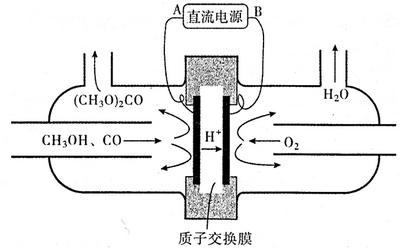
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
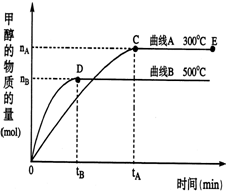 一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:
一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 浓硫酸稀释时,应该将水缓缓加入盛浓硫酸的烧杯中,边加边搅拌 | |
| D. | 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
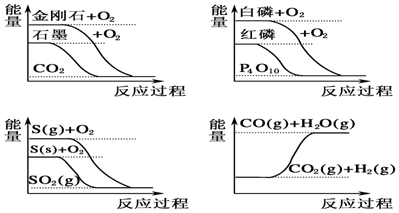
| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | 石墨转变为金刚石是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的(NH4)2SO4溶液:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯酚中“C═C”的个数为3 NA | |
| B. | 常温常压下,22.4L丙烷所含有的共价键数目为10NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$ NA | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com