
| A. | 蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 浓硫酸稀释时,应该将水缓缓加入盛浓硫酸的烧杯中,边加边搅拌 | |
| D. | 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
分析 A.蒸发时,利用余热加热,不能蒸干;
B.蒸馏时,测定馏分的温度;
C.稀释时将密度大的液体注入密度小的液体中;
D.分液时,避免上下层液体混合.
解答 解:A.蒸发时,利用余热加热,不能蒸干,则蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干,故A正确;
B.蒸馏时,测定馏分的温度,则应使温度计水银球靠近蒸馏烧瓶的支管口处,故B正确;
C.稀释时将密度大的液体注入密度小的液体中,则浓硫酸稀释时,应该将浓硫酸缓缓加入盛水的烧杯中,边加边搅拌,故C错误;
D.分液时,避免上下层液体混合,则分液漏斗下层液体从下口放出,上层液体从上口倒出,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握分离方法、实验操作、实验技能为解答关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
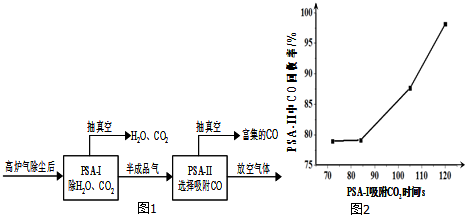
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
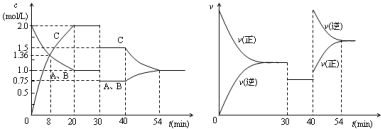
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
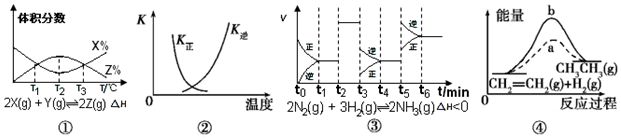
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
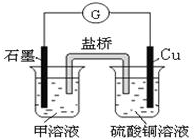
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu | B. | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | AgNO3+NaCl═AgCl↓+NaNO3 | D. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com