
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
【答案】A
【解析】试题分析:①单位时间内生成n mol O2的同时生成2n mol NO2,能说明正逆反应速率的相等关系,①正确;②单位时间内生成n mol O2的同时生成2n molNO只能说明单方向关系,不能说明正逆反应速率的关系,②错误;③混合气体的颜色不变化,说明二氧化氮的浓度不变化,达到平衡状态,③正确;④该反应是一个反应前后气体的质量不会改变的化学反应,混合气体的质量是守恒的,容器的体积不变,导致混合气体的密度不再变化,所以该反应不一定达到平衡状态,④错误;⑤混合气体的平均相对分子质量=平均摩尔质量= 混合气体的总质量 混合气体的总物质的量 ,质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,⑤正确;⑥混合气体中NO与O2的物质的量之比保持恒定是反应过程中任何时候都有的,该反应不一定达到平衡状态,⑥错误;⑦混合气体中NO与NO2的物质的量之比保持恒定,说明它们的物质的量就不变,浓度不变,该反应达到了平衡状态,⑦正确;达到平衡状态的标志有①③⑤⑦,故选A。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。回答下列问题:
(1)N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为____________;白磷的分子式为P4,4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为____________。
(2)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式___________________________,联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为_________________________________。
(3)P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。
A.SO2 B.NH3 C.CO D.H2 E.H2S F.O2
(4)次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________,Ba(H2PO2)2为_______________(填“正盐”或“酸式盐”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置进行相应的实验,不能达到实验目的的是( )
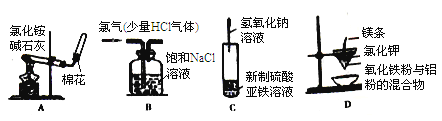
A.实验室制取并收集氨气 B.除去Cl2中的HCl气体杂质
C.实验室制取氢氧化亚铁 D.铝热反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲 ![]() 乙
乙 ![]() 丙.下列有关物质的推断不正确的是( )
丙.下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为AlCl3 , 则丁可能是NaOH
C.若甲为Fe,则丁可能是氯气
D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O (莫尔盐,浅绿色)是重要的化工原料和化学试剂。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
(1)甲组同学猜想:莫尔盐的分解产物可能是N2、Fe2O3、SO3和H2O四种物质。你是否同意甲组同学的猜想,并说明理由:______________________。
(2)乙组同学按照如下图所示的装置进行实验,关闭止水夹,加热A中的莫尔盐固体至分解完全,检验其分解产物。
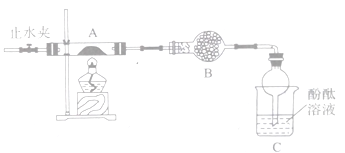
①装置B的仪器名称是______________,所盛试剂是_________________。
②装置C中可观察到的现象是________________, 由此可知硫酸亚铁铵分解的产物中有___________。
(3)丙组同学选用乙组实验中的装置A和下图所示的装置,进行实验验证莫尔盐分解的产物中还有SO2和SO3。
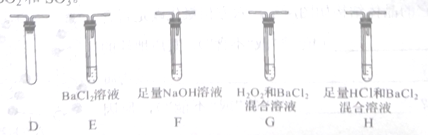
①丙组同学的实验装置中,依次连接的合理顺序为A______________(用装置字母表示)。取适量固体于A中,通入 N2一段时间后,关闭止水夹,冉点燃酒精灯。通入N2的目的是___________________ 。
②若装置H中有白色沉淀生成,则证明分解产物中有__________________;能证明分解产物中有SO2的实验现象是___________________ 。
(4)丁组同学将一定量的莫尔盐在500℃的隔绝空气加热—段时间后,检验其固体产物。设计实验证明,此固体产物不含二价铁:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe与稀HNO3反应时,若两者消耗物质的量之比为4∶10,且生成 Fe(NO3)2,则反应中生成的还原产物可能是( )
A.N2B.N2OC.NOD.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
① CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____________。
(2)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图所示,则阴极的电极反应式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com