
【题目】下列反应中,不可能在有机物中引入羧基的是( )
A.卤代烃的水解B.脂类在酸性条件下水解
C.醛的氧化D.烯烃的氧化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列有关反应的化学方程式,并注明有关反应条件:
(1)2-溴丙烷消去反应方程式________________________________;
(2)1,3-丁二烯的加聚反应方程式____________________________;
(3)CH3CH2CHO与新制Cu(OH)2反应的方程式_________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l)=H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
A.使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OCH3从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①合成甲醇的反应为_______(填 “放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________。
③达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
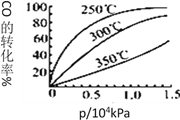
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能够大量共存的是( )
A. K+、Na+、OH-、Cl- B. Na+、Mg2+、SO42-、OH-
C. H+、Ca2+、Cl-、CO32- D. Cu2+、Ba2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。己知:酸性条件下,锡在水洛液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化、易水解生成碱式氯化亚锡(Sn(OH)Cl);SnCl4极易水解。请按要求回答下列相关问题:
(1)锡原子的核电荷数为50,锡的原子结构示意图为________________。
(2) SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因____________。
SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为______________。
(3)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: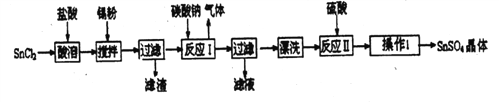
①操作Ⅰ是___________。
②加入Sn粉的作用有两个:a.调节溶液pH; b.__________.
③反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是______________。
(4)锡粉可用于微电子器件生产,该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将1.2g试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑;②加入过量的FeCl3;③用0.1 mol/L的K2Cr2O7滴定生成的Fe2+ (己知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液32mL。则锡粉中锡的质量分数是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com