
【题目】下列各组离子在溶液中能够大量共存的是( )
A. K+、Na+、OH-、Cl- B. Na+、Mg2+、SO42-、OH-
C. H+、Ca2+、Cl-、CO32- D. Cu2+、Ba2+、Cl-、SO42-
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
① CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____________。
(2)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图所示,则阴极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2Na2O2 + 2H2O === 4NaOH + O2,下列说法中正确的是 ( )
A. Na2O2是氧化剂,H2O是还原剂
B. Na2O2既是氧化剂,又是还原剂
C. 该反应中电子转移的数目为4e-
D. O2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.所有酯类和糖类都可以发生水解反应
B.分馏石油得到的各个馏分都是混合物
C.棉花和蚕丝的主要成分都是纤维素
D.动物脂肪和植物油都属于酯类,都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
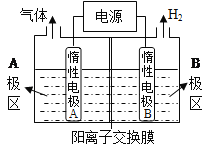
①B极区电解液为____________溶液(填化学式),A极要连接电源的_________(填“正”或“负”)极。
②阳极电极反应式为__________________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)

②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作为氧化剂的是( )
A. NaOH+HCl= NaCl+H2O B. CaO+H2O = Ca(OH)2
C. 2Na+2H2O= 2NaOH+H2↑ D. Cl2+H2O = HCl + HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com