
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)ΔH1
CH3CH2OH(g)+H2O(g)ΔH1
又已知:H2O(l)=H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
CH3OCH3(g)+H2O(g)。下列措施中能够同时满足增大反应速率和提高CO转化率的是____(填字母)。
A.使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OCH3从反应混合物中分离出来
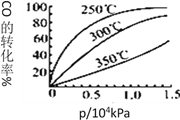
(3)采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+ 2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①合成甲醇的反应为_______(填 “放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________。
③达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示,实际生产时条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
【答案】 ΔH1 -2△H3-3△H2 C 放热 KA=KB>KC 2 250℃、1.3×104 kPa下,CO转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加
【解析】(1)已知:①2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H1,②H2O(1)═H2O(g)△H2,③CO(g)+H2O(g)CO2(g)+H2(g)△H3,根据盖斯定律,将①-②×3-③×2得:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,故答案为:△H=△H1-3△H2-2△H3;
(2)A、使用高效催化剂只能增大反应速率,不能改变平衡移动,所以CO的转化率不变,故A错误;B、降低反应温度会减慢反应速率,故B错误;C、增大体系压强不仅增大反应速率,而且平衡也向正反应方向移动,所以CO的转化率也增大,故C正确;D、不断将CH3OCH3从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小,故D错误;故答案为:C;
(3)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则KA=KB,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故KB>KC,故KA=KB>KC,故答案为:KA=KB>KC;
③A、B两点温度相等,压强不同,平衡常数相同,对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K= =1,对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
=1,对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则 =1,解得V=2,故答案为:2;
=1,解得V=2,故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,生产成本却增加。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Fe与稀HNO3反应时,若两者消耗物质的量之比为4∶10,且生成 Fe(NO3)2,则反应中生成的还原产物可能是( )
A.N2B.N2OC.NOD.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl﹣)= ![]() c(Na+)=c(SO
c(Na+)=c(SO ![]() ),则其溶质可能是( )
),则其溶质可能是( )
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、K2SO4
D.KCl、K2SO4、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO(填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2Na2O2 + 2H2O === 4NaOH + O2,下列说法中正确的是 ( )
A. Na2O2是氧化剂,H2O是还原剂
B. Na2O2既是氧化剂,又是还原剂
C. 该反应中电子转移的数目为4e-
D. O2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 84消毒液
[有效成分]NaClO
[规格]1000mL
[质量分数]25%
[密度]1.19gcm﹣3
(1)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液,需要称量NaClO固体的质量为g;所用到的玻璃仪器有玻璃棒、烧杯、量筒和 .
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力. ①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
(4)配置一定物质的量浓度的稀硫酸时,下列操作会使所配溶液物质的量浓度偏低的是 .
A.定容时俯视容量瓶刻度线
B.用量筒量取浓硫酸时俯视刻度线
C.容量瓶用蒸馏水洗涤干净后没有干燥就移入所配置溶液
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线.
E.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com