
【题目】在下图所示的物质转化关系中,A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成无没有全部列出,反应条件未列出)

请回答下列问题:
(1)E的化学式为_____________________________。
(2)实验室制取A的化学方程式为_______________________________。
(3)反应①的化学方程式:___________________________________。
(4)反应③的化学方程式:__________________________________。
【答案】HNO3 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O 3NO3+H2O=2HNO3+NO 4NH3+5O2=4NO+6H2O
【解析】
B是能使带火星的木条复燃的无色无味气体,则B是氧气;G是一种紫红色金属单质,则G是铜;A是常见气态氢化物,且能和氧气反应,所以根据图中的转化可以判断,A可能是氨气,则C就是NO,F是水。NO和氧气反应生成NO2,NO2溶于水生成硝酸,则E是硝酸,硝酸和铜反应又生成NO,据此答题。
(1)由以上分析可知E为HNO3,故答案为:HNO3。
(2)由以上分析可知A为NH3,实验室制取氨气用氯化铵与氢氧化钙共热,反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
(3)反应①为二氧化氮与水反应生成硝酸与NO,反应的方程式为:3NO3+H2O=2HNO3+NO,故答案为:3NO3+H2O=2HNO3+NO。
(4)反应③为氨的催化氧化,反应生成NO和H2O,化学方程式为:4NH3+5O2=4NO+6H2O,故答案为:4NH3+5O2=4NO+6H2O。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B.pH在5.6~7之间的降水通常称为酸雨
C.合金的硬度一般比成分金属的大
D.硫粉在过量的纯氧中燃烧可生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是( )
A. 澄清石灰水中通入过量二氧化硫:Ca2+ +2OH +SO2 ===CaSO3↓+H2O
B. 碳酸钠溶液中加入二氧化硅:CO32 +SiO2==SiO32 +CO2↑
C. 二氧化硅与烧碱溶液反应:SiO2 +2OH === SiO32+H2O
D. 硅酸与烧碱溶液中和:H2SiO3 +2OH === SiO32+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
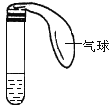
(1)在试管中注入某红色溶液,加热试管,气球胀大,溶液颜色逐渐变浅,冷却后气球干瘪,溶液颜色恢复红色,则原溶液可能是________________溶液;加热时,溶液由红色逐渐变浅的原因是:______________。
(2)在试管中注入某无色溶液,加热试管,气球胀大,溶液变为红色,冷却后气球干瘪,溶液颜色恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氯化氢气体 ②氨气 ③金属钠 ④ 硝酸钾⑤ 酒精⑥ 氢氧化钠溶液(用编号回答)其中属于电解质的有__;其中属于非电解质的有__;能导电的物质__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=________。
(2)一定温度下,CdCO3的Ksp=4.0 × 10-12,Cd(OH)2的Ksp=3.2 × 10-14,那么它们在水中的溶解量________较大。
(3)在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Ar(Cd)=112);此时是否符合水源标准?______(填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
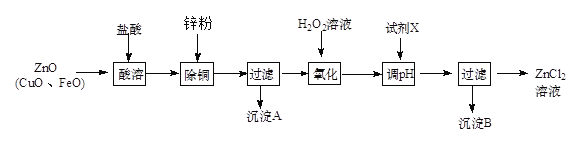
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
(1)加入H2O2溶液的作用是________________。
(2)流程图中,调节pH时,加入的试剂X可以是________(填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硫的叙述中,不正确的是( )
A.是一种无色有毒的气体
B.具有强烈的刺激性气味
C.能溶于水,与水反应生成亚硫酸
D.水溶液能导电,二氧化硫是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是( )
A. 化学键断裂需要吸收能量
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 在化学反应过程中反应物的总能量总是等于生成物的总能量
D. 吸热反应需要在加热的条件下才能进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com