
【题目】下列物质:①氯化氢气体 ②氨气 ③金属钠 ④ 硝酸钾⑤ 酒精⑥ 氢氧化钠溶液(用编号回答)其中属于电解质的有__;其中属于非电解质的有__;能导电的物质__。
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是( )
A.Na2O2→Na2CO3B.SO2→H2 SO4C.SiO2→Na2SiO3D.SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纯铁为灰黑色,所以铁属于黑色金属
B. 铁在硫蒸气中燃烧生成Fe2S3
C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化
D. 足量的铁在氯气中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
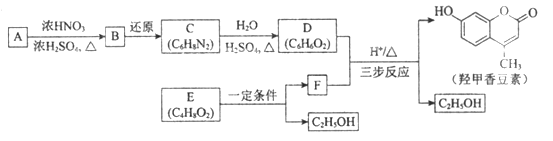
己知:
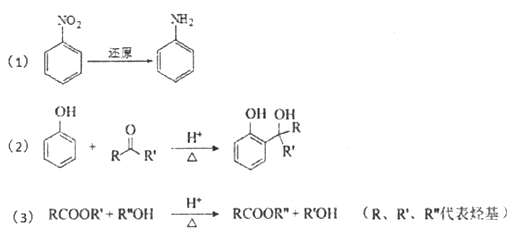
请回答下列问题:
(1)A属于芳香烃,其结构简式是____________;B中所含的官能团是____________。
(2)C→D的反应类型是____________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式____________。
(4)己知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和____________。
和____________。
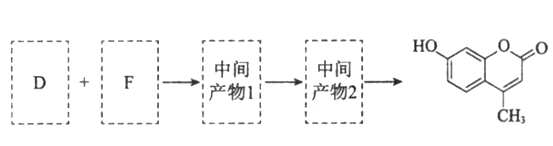
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成无没有全部列出,反应条件未列出)

请回答下列问题:
(1)E的化学式为_____________________________。
(2)实验室制取A的化学方程式为_______________________________。
(3)反应①的化学方程式:___________________________________。
(4)反应③的化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出______________kJ 的热量。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷分子的结构式为_________,空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__________________________________________。
(3)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(4)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO-), 下列说法正确的是( )
A. b<0.01
B. 混合后溶液呈碱性
C. 常温下,所得溶液中CH3COOH的的电离常数Ka=![]() mol·L-1
mol·L-1
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:___________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+![]() O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+![]() O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是___________。
(3)氢氧化镁可以作为阻燃剂的原因_________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
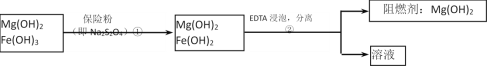
(4)步骤②中分离操作的名称是__________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是__________mol。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com