
目前工业合成氨的原理是:N2(g)+3H2(g)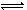 2NH3(g)
△H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g)
△H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)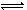 4NH3(g)+3O2(g)
△H= +1530.0kJ /mol。
4NH3(g)+3O2(g)
△H= +1530.0kJ /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩装置,生成更多NH3
(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
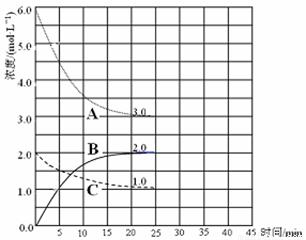
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
(16分)
(1)-286.0 (2分,不写“-”扣1分)
(2)AD (2分)
(3)① C (2分)
② 0.12 mol / (L·min) (3分,数据2分,单位1分)
③ 0.15 (2分)
(4)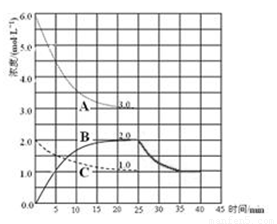 (3分,起点1分,拐点1分,延长线1分)
(3分,起点1分,拐点1分,延长线1分)
(5) 5 (2分)
【解析】
试题分析:(1)先将已知两个热化学方程式编号为①②,再根据盖斯定律,将(①×2—②)/3可得:2H2(g)+O2(g)=
2H2O(l) △H=-572.0kJ /mol,最后将系数减半,则焓变随之减半,即H2(g)+O2(g)= 2H2O(l)
△H=-286.0kJ /mol;根据燃烧热概念可得,氢气的燃烧热△H=-286.0kJ /mol;(2)恒温恒压下,气体摩尔体积相同,由于n=V/Vm,则气体体积不再变化,就是气体的物质的量不再变化,说明反应已达平衡,故A正确;气体密度等于气体质量除以气体总体积,根据质量守恒定律可知气体质量始终不变,若气体密度不再变化时,则气体总体积不变,气体的物质的量不变,说明反应已达平衡,故B错;平衡后充入惰性气体,维持恒温恒压,必须增大容器容积,减小各组分浓度,其实质是减小压强,平衡向逆反应方向或气体体积增大方向移动,故C错;平衡后,压缩装置,缩小容器容积,其实质是增大压强,平衡向正反应方向或气体体积减小方向移动,故D正确;(3)①合成氨的原理为N2(g)+3H2(g)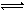 2NH3(g),读图可知,前25min内A的浓度由6.0mol/L逐渐减小为3.0mol/L,C的浓度由2.0mol/L逐渐减小到1.0mol/L,B的浓度由0逐渐增大到2.0mol/L,则A、C、B的变化浓度分别为3.0mol/L、1.0mol/L、2.0mol/L,因此A、C、B分别表示氢气、氮气和氨气的浓度随反应时间变化的曲线;②由于前25min内氢气的浓度由6.0mol/L逐渐减小为3.0mol/L,其变化浓度为3.0mol/L,则v(H2)=△c(H2)/△t=3.0mol/L÷25min =0.12 mol / (L·min);③根据三行数据法可得:
2NH3(g),读图可知,前25min内A的浓度由6.0mol/L逐渐减小为3.0mol/L,C的浓度由2.0mol/L逐渐减小到1.0mol/L,B的浓度由0逐渐增大到2.0mol/L,则A、C、B的变化浓度分别为3.0mol/L、1.0mol/L、2.0mol/L,因此A、C、B分别表示氢气、氮气和氨气的浓度随反应时间变化的曲线;②由于前25min内氢气的浓度由6.0mol/L逐渐减小为3.0mol/L,其变化浓度为3.0mol/L,则v(H2)=△c(H2)/△t=3.0mol/L÷25min =0.12 mol / (L·min);③根据三行数据法可得:
N2(g)+3H2(g)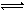 2NH3(g)
2NH3(g)
各组分的起始浓度/ mol·L-1 2.0 6.0 0
各组分的变化浓度/ mol·L-1 1.0 3.0 2.0
各组分的平衡浓度/ mol·L-1 1.0 3.0 2.0
K= =
=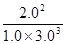 ≈0.15(保留两位有效数字)
≈0.15(保留两位有效数字)
(4)由于合成氨的正反应的△H=-93.0kJ /mol,则正反应是放热反应,升高温度,平衡向吸热反应方向移动,即平衡向逆反应方向移动,则反应物浓度增大,氨气浓度减小,根据三行数据法可得:
N2(g)+3H2(g)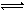 2NH3(g)
2NH3(g)
25min时各组分浓度/ mol·L-1 1.0 3.0 2.0
各组分的变化浓度/ mol·L-1 0.5 1.5 1.0
35min时各组分浓度/ mol·L-1 1.5 4.5 1.0
因此,25min→35min,氨气浓度由2.0mol/L逐渐减小为1.0mol/L;35min→40min,氨气浓度为1.0mol/L,始终保持不变;(5)氯化铵是强酸弱碱盐,其完全电离出的铵根离子部分水解,生成一水合氨和氢离子,存在水解平衡,设溶液中氢离子浓度为xmol/L,由三行数据法可得:
NH4++H2O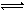 NH3•H2O+H+
NH3•H2O+H+
各组分的起始浓度/ mol·L-1 0.1 0 0
各组分的变化浓度/ mol·L-1 x x x
各组分的平衡浓度/ mol·L-1 0.1—x x x
K=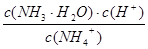 =
= =1.0×10-9
=1.0×10-9
由于铵根离子水解程度很小,则0.1—x≈0.1,则 =
=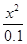 =1.0×10-9,则x 2=1.0×10-10,x=1.0×10-5;由于pH=—lgc(H+)=5。
=1.0×10-9,则x 2=1.0×10-10,x=1.0×10-5;由于pH=—lgc(H+)=5。
考点:考查化学反应原理,涉及盖斯定律、燃烧热、表示燃烧热的热化学方程式、化学平衡的标志、外界条件对平衡移动的影响、体系各组分浓度与反应时间曲线的识别、平均反应速率的计算、化学平衡常数的计算、放热反应和吸热反应、温度对平衡移动的影响、画出温度对生成物浓度与反应时间关系的图像、盐类水解平衡常数的应用、计算溶液的pH等。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |


| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源:2011届江西省安福中学高三上学期第四次月考化学试卷 题型:实验题
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式: 。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度 (填增大、不变或减小,下同),NH3的体积分数 。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省石家庄市毕业班教学质量检测(二)理综化学试卷(解析版) 题型:填空题
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
??????????? 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=??????????? 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K=?? 。
N2(g)+3H2(g)的平衡常数K=?? 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为?????? (填选项字母)。
A.a=l、b=3.c=0? ?????? B.a=4、b=12、c=0
C.a=0、b=0.c=4? ???? D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 ??????? 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?? ___极,该电极反应式为?????????????????????? 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入?? ___极,该电极反应式为?????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省日照市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)  2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。

III.目前工业合成氨的原理是:N2(g)+3H2(g)  2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com