
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )

A. 简单离子半径:M<R
B. 氢化物的稳定性:Y<Z
C. M的氢化物常温常压下为气体
D. X、R、Y、Z均存在两种及两种以上的氧化物
【答案】A
【解析】X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素。A.硫离子比钠离子多一个电子层,硫离子半径较大,故A错误;B.非金属性N>C,元素的非金属性越强,对应的氢化物越稳定,故B正确;C.M的氢化物的硫化氢,常温下为气体,故C正确;D. X、R、Y、Z均存在的氧化物有水和双氧水、氧化钠和过氧化钠、一氧化碳和二氧化碳、一氧化氮和二氧化氮以及四氧化二氮等,均在两种及两种以上,故D正确;故选A。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是

A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CH2=CH2+H2 → CH3CH3,反应过程的能量变化如图所示。下列说法正确的是

A. 此反应不属于氧化还原反应
B. 此反应的ΔH<0
C. 此反应中反应物的能量总和大于产物的能量总和
D. 1分子乙烯和1分子氢气的键能总和大于1分子乙烷的键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。
甲. ![]()
乙. ![]()
(1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________ (用化学方程式表示)。
(2)乙同学方案中NaOH固体的作用为_____________________________________________。
(3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):

①按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母);
②装置B的作用为___________,装置D的作用为__________________________。
Ⅱ.定性分析产物
操作步明 | 实验现象 | 解释原因 |
取少量产品于试管中,加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | (4)反应的化学方程式为___________ |
. | ||
弃去上层淸液,加入足量稀盐酸 | 观察到固体全部溶解,且有气泡冒出 | (5)气泡冒出的原因为_____________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。
(6)产物中氮化镁的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应5NH4NO3 = 4N2↑+2HNO3+9H2O 中,发生还原反应的氮元素与发生氧化反应的氮元素的物质的量之比为
A. 5:3 B. 3:5
C. 5:4 D. 4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于O2与O3气体,下列比值一定为2:3的是( )
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度和压强相同,两种气体的密度之比
C.若两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
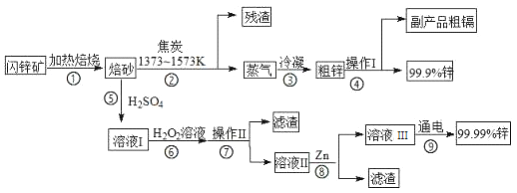
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点 (K) | 693 | 1812 | 1356 | 594 |
沸点 (K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
Fe3+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀pH | l.l | 5.9 | 4.7 | 6.9 |
完全沉淀pH | 3.2 | 8.9 | 6.7 | 9.6 /span> |
请回答下列问题:
(1) 步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程式___________________________________________________。
(2)步骤④中操作I的分离方法为蒸馏,得到副产品粗镉需控制温度为____左右。
(3)步骤⑦需调节溶液pH为_______,目的是_____________________________。
(4)写出步骤⑧中反应的离子方程式___________________________(任写一个)
(5)步骤⑨以Pt为电极进行电解,阴极的电极反应方程式为________________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com