
下列叙述中正确的是
A.Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质
B.蔗糖、油脂及它们的水解产物均为非电解质
C.海水提取溴、煤的液化、焰色反应都发生了化学变化
D.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:
在前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是
A.氢氧化铁胶体中滴加盐酸 B.偏铝酸钠溶液中加盐酸
C.氯化铝溶液中滴加氢氧化钠溶液 D.氯化铝溶液中滴加氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法:
(1)CO(CO2):__________________________________________________________。
(2)CO2(CO):__________________________________________________________。
(3)CO2(O2):__________________________________________________________。
(4)CO2(SO2):_________________________________________________________。
(5)CO2(HCl):_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SiO2和CO2的叙述中不正确的是 ( )
A.都是共价化合物
B.都是酸性氧化物,都能与强碱溶液反应
C.都能溶于水且与水反应生成相应的酸
D.SiO2可用于制光导纤维,干冰可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂物质的量之比是3∶4
C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,烟幕的主要成分是NH4Cl
D.从燃煤烟道灰(含GeO2)中提取半导体材料单质锗(Ge),没有发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中
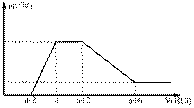 A.不含SO42-
A.不含SO42-
B.含有的阴离子一定是OH-、AlO2-、SiO32-
C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32-
D.含有AlO2-与SiO32-的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)


(1)A、C的结构简式分别是 、 ,D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:
。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方
程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用软锰矿(只含MnO2和MnO)、H2SO4(过量)和FeS2制备MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反应):

(1)已知①中只有三个反应,其中两个反应是
MnO+H2SO4===MnSO4+H2O
FeS2+H2SO4===FeSO4+H2S↑+S↓
完成第三个反应: MnO2+
MnO2+ FeSO4+
FeSO4+ ________===
________=== MnSO4+
MnSO4+ ________+
________+ ________
________
(2)沉淀A、B的化学式分别是___________________。
(3)滤液X中的溶质有__________________;实验室中浓缩滤液Y时使用的玻璃仪器有__________________。
(4)若得到的沉淀A的质量和MnSO4·H2O的质量分别为96.0 g、321.1 g,②中加入的MnO为0.1 mol,则理论上软锰矿中MnO2和MnO的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。如图所示是模拟工业制备氢溴酸粗产品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为_______________________________________。
(2)混合①中使用冰水的目的是____________________________________________。
(3)操作Ⅲ一般适用于分离________混合物(填序号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中 加入Na2SO3的目的是__________________________________________。
加入Na2SO3的目的是__________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验进行探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有______________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com