
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
C
解析试题分析:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,则:
A.加入CaO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Ca2+数目减少,故A错误;B.反应后仍为饱和溶液,c(Ca2+)不变,故B错误;C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C正确;D.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故D错误,答案选C。
考点:考查难溶电解质的溶解平衡
点评:该题是中等难度的试题,侧重对学生分析、归纳和总结问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意向悬浊液中加少量生石灰,发生反应CaO+H2O=Ca(OH)2,注意从平衡移动的角度分析和判断。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
把0.2 mol?L-1CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)> c(CH3COO-) |
| C.c(CH3COOH)+ c(CH3COO-)=0.1mol?L-1 |
| D.加入少量NaOH固体,c(Na+)增大而c(CH3COO-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于10mL0.1 mol.·L-1的NH3 ? H2O溶液,下列说法正确的是
| A.25°C时,若溶液的 pH=11,则 Kb(NH3 ? H2O) = 1X10-6 mol.L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中 的值变小 的值变小 |
| C.向溶液中加入10mL 0.1 mol.L-1HC1,所得溶液中离子浓度大小顺序为C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| D.向溶液中加入5mL0.1mol/LHC1,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计)。下列说法中,不正确的是
| A.HA为一元强酸 |
| B.MOH为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
B.pH 相等的CH3COONa 和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
D.0.1 mol·L-1的NaHA 溶液 pH=l:c(Na+)= c(H2A) + c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)水的电离平衡曲线如图所示: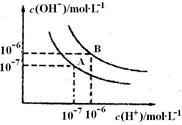
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示): 、 、 。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com