
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
D
解析试题分析:选项A中根据物料守恒可知,物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后c(CH3COO-) + c(CH3COOH)=2c(Na+),A正确;选项B中由于碳酸钠的水解程度大于碳酸氢钠的水解程度,则物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合中离子浓度的大小顺序是: c (Na+)>c (HCO3-)>c(CO32-) >c(OH-)>c(H+),B正确;选项C中醋酸钠水解,则根据质子守恒可知,c(OH-)=c(CH3COOH) +c(H+),C正确;选项D中根据质子守恒可知,1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),D不正确,答案选D。
考点:考查溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合题意灵活运用即可。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:单选题
现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( ) 
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: |
B.已知NaHSO3溶液 ,该溶液中: ,该溶液中: |
C.当吸收液呈中性时: |
D.当吸收液呈酸性时: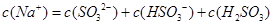 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: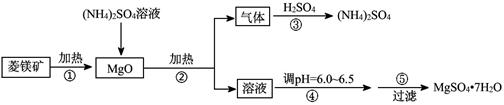
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com