
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: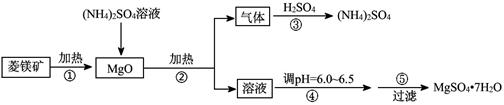
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(1) 2NH4+ + MgO=Mg2+ + 2NH3↑+ H2O (2分)
(2)抑制Mg2+水解,以便得到更多更纯的产品 (2分)
(3)蒸发浓缩,冷却结晶(2分) (4)蓝色(2分)。
解析试题分析:(1)硫酸铵是强酸弱碱盐,水解使溶液显酸性,所以步骤②中发生反应的离子方程式为2NH4+ + MgO=Mg2++ 2NH3↑+ H2O;(2)步骤④中调节pH=6.0~6.5的目的是抑制Mg2+水解,以便得到更多更纯的产品;(3)步骤⑤的操作为蒸发浓缩,冷却结晶;(4)假设在25℃时,Mg(OH)2的饱和溶液中c(Mg2+)=x;c(OH-)=2x;x×(2x)2=5.6×10-12;解得x=1.13×10-4;所以c(OH-)=2.26×10-4; 所以溶液的pH="9.7," 向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色。
考点:考查物质制取原理,主要包括盐的水解、沉淀溶解平衡、混合物的分离操作、操作的目的等知识。


科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是: c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则 c(OH-)-c(HY)=c(H+)=1×10-5mol/L |
| C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计)。下列说法中,不正确的是
| A.HA为一元强酸 |
| B.MOH为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合: 离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| C.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+) |
| D.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)水的电离平衡曲线如图所示: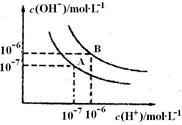
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m n(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH 7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为 ,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com