
| A. | CH2Br2 | B. | C4H8 | C. | C2H6O | D. | C5H10 |
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
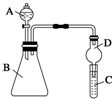 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期中非金属性最强的元素位于本周期最右边 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 原子序数为38的元素位于元素周期表的第五周期,第ⅡA族 | |
| D. | 第二周期,第ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com